Библиотека
Теология
Конфессии
Иностранные языки
Другие проекты
|
Ваш комментарий о книге
Орлов В. и др. Исследование хромосомных наборов млекопитающих
I ПРИГОТОВЛЕНИЕ ХРОМОСОМНЫХ ПРЕПАРАТОВ
Метод давленых препаратов
Метод давленых препаратов в настоящее время имеет преимущественно исторический интерес и применяется редко, поскольку он технически сложнее и чаще приводит к артефактам. Часть метафазных пластинок неминуемо разрушается, в то время как многие клетки плохо распластываются, хромосомы лежат скучепно и не в одной плоскости. Приходится готовить большое количество препаратов, чтобы отыскать на них клетки, пригодные для исследования. Этим методом до сих пор пользуются лишь немногие исследователи, однако некоторые, прибегая к различным усовершенствованиям, добиваются хороших результатов. В литературе можно найти несколько методик получения давленых препаратов хромосом. Их различия сводятся к применению разных гипотонических растворов (дистиллированная вода, раствор цитрата натрия) или фиксаторов. Ниже мы
5
приводим методику, по которой работали в 60х годах в лаборатории Р. Маттея.
Предварительно колхицинированное животное забивают и берут кусочки селезенки или костного мозга размером около 1 мм. Кусочки ткани помещают на 10 мин. в дистиллированную воду (гипотоническое воздействие), а затем переносят на 2030 мин. в 50%ную уксусную кислоту. Далее кусочек ткани переносят на чистое предметное стекло, предварительно смазанное куриным белком, закрывают покровным стеклом и изо всех сил надавливают на покровное стекло большим пальцем. Некоторые исследователи заворачивают препарат, т. е. предметное стекло с кусочком ткани, закрытым покровным стеклом, в фильтровальную бумагу и помещают под пресс. Постоянное давление на препарат, создаваемое грузом, может быть успешно усилено с помощью рычага до 75 кг.
Предметное стекло переносят в кювету с 70%ным спиртом, закрывают и оставляют там на 23 дня. В спирте покровное стекло отпадает и остаётся только ткань, приклеенная к предметному стеклу. После этого препарат промывают два раза в дистиллированной воде. Вслед за этим препарат в течение 12 мин. подвергают гидролизу в 1%ном растворе соляной кислоты в термостате при 58°С. После гидролиза препарат два раза промывают в дистиллированной воде. Окрашивают хромосомы по методу Фельгена или гематоксилином по Эрлиху.
Метод высушенных препаратов
С тех пор, как в конце 50х годов появились первые описания этого метода, было предложено очень много его модификаций. В настоящее время почти каждый исследователь, длительное время работавший с хромосомами, пользуется собственной вариацией этого метода или пробует его различные видоизменения. Ниже приводится методика, по которой мы работали последнее время. Следует отметить, что описанная методика, точнее та её часть, которая касается колхицинирования in vivo, может быть использована при работе только с мелкими зверьками или млекопитающими средних размеров (например, до соболя пли бобра включительно). При этом исследователь должен располагать живыми зверями, которым вводят впутрибрюшинно колхицин и которых через некоторое время забивают. В тех случаях, когда предстоит исследовать хромосомный набор зверей крупных размеров или имеется свежий трупный матери
6
ал, пользуются иными способами приготовления хромосомных препаратов (кратковременная культура клеток костного мозга, культура лейкоцитов крови и др.). Однако во всех случаях непосредственное приготовление хромосомных препаратов, начиная с гипотонического воздействия на клетки, остаётся в сущности неизменным. Кроветворные органы костный мозг и селезёнка удобны в том отношении, что межклеточные связи в них очень слабые. В других случаях (например, приготовляя хромосомные препараты из роговицы глаза) ткань приходится измельчать механически (и при этом многие клетки разрушаются) или разрывать межклеточные связи ферментами (трипсином). Ниже описана методика приготовления хромосомных препаратов из клеток костного мозга. С незначительными изменениями она пригодна для любой митотически активной ткани.
1. Животному внутрибрюшинно ввести 0,04%ный раствор колхицина в количестве 0,01 мл на 1 г веса.
2. Через 1 час животное забить, быстро извлечь бедренные кости, очистить их от прилегающих мышц и отрезать эпифизы. Костный мозг из бедренной кости вымыть тёплым (37°С) гипотоническим раствором в центрифужную пробирку, используя для этой цели медицинский шприц с иглой. В качестве гипотонического раствора можно использовать 0,9%ный раствор цитрата натрия (трехзамещённый лимоннокислый натрий) или 0,56%ный раствор хлористого калия.
3. Кусочки костного мозга измельчить с помощью пастеровской пипетки или медицинского шприца с иглой, несколько раз энергично всасывая и выдувая жидкость. Полученную клеточную суспензию инкубировать в гипотонической среде: в случае использования цитрата натрия 1530 мин. и в варианте с использованием хлорида калия 5 мин. при температуре 37°С.
4. Отцентрифугировать полученную суспензию в течение 5 мин. при 8001000 об/мин. Осадка в пробирке должно быть немного (тонкий слой на дне пробирки).
5. Осторожно слить или отсосать пипеткой всю надосадочную жидкость, стараясь при этом не потревожить осадка. Клетки фиксировать смесью метилового спирта с ледяной уксусной кислотой (3 части метилового спирта и 1 часть уксусной кислоты). Вместо метилового спирта можно использовать этиловый спирт. К осадку осторожно прилить свежеприготовленный и охлажденный фиксатор. Фиксатора наливают около 2 мл, стараясь не разбить осадок. Очень часто фиксацию осадка начинают иначе. Фиксатор приливают очень медленно, по одной
7
капле, и энергично встряхивают пробирку, чтобы добиться однородной взвеси клеток в фиксаторе. Мы испробовали и сравнивали оба способа фиксации, по затрудняемся отдать какомулибо из них предпочтение. В полевых условиях удобен первый способ, так как при нем сокращается число последующих центрифугирований.
6. Общее время фиксации 12 часа. Однако фиксировать и даже хранить взвесь клеток в фиксаторе на холоду можно довольно долго, если исключить высыхание фиксатора. За время фиксации необходимо сменить 23 раза фиксатор, с промежуточным ресуспензированием осадка и последующим центрифугированием. Если осадок с самого начала фиксировался целой глыбкой, то старый фиксатор можно осторожно отсосать пипеткой и налить свежий без ресуспепзирования.
7. В последнем фиксаторе осадок ресуспензируется. Фиксатора налить немного (обычно 0,5 мл) так, чтобы получилась молочного цвета слегка опалесцирующая взвесь.
8. На чисто вымытое предметное стекло (стекла держать в дистиллированной воде в холодильнике) нанести 23 капли суспензии клеток в фиксаторе. Стекло быстро провести через пламя горелки, чтобы фиксатор воспламенился, но не допускать перегревания. Фиксатор при этом выгорает, а клетки прочно фиксируются к стеклу. Лишняя влага высушивается феном или сдувается грушей.
9. Хорошо высушенные препараты окрашиваются различными красителями, в зависимости от цели, стоящей перед исследователем (см. раздел «Различные способы окраски хромосомных препаратов»).
Качество хромосомных препаратов зависит от тщательности подготовки предметных стёкол. Предметные стекла вымыть ватным тампоном в мыльной воде и поставить прокипятить в воде с детским мылом или стиральным порошком 1015 мин. Каждое стекло отдельно промыть в нескольких сменах горячей воды до полного отмывания мыла. Хорошо отмытые стекла поместить в раствор хромпика на 812 час. За несколько часов до фиксации стекла отмыть от хромпика в водопроводной воде и в нескольких сменах дистиллированной воды и в последней дистиллированной воде стекла поставить в холодильник.
8
Хромосомные препараты из кратковременной культуры клеток
Кратковременная культура клеток и колхицинирование in vitro дают возможность приготовить хромосомные препараты в таких случаях, когда описанная выше методика неприменима. Таким образом удаётся получить хорошие хромосомные препараты из пунктата костного мозга, взятого прижизненно, при отстрелах животных, а также вообще из любых забитых животных, после смерти которых прошло от 1 часа до десятков часов (в зависимости от температуры, при которой хранился труп). Малая трудоёмкость и быстрота приготовления хромосомных препаратов, а также ненужность соблюдения стерильности позволяют применять эту методику в полевых условиях.
Лучшие результаты даёт использование костного мозга, извлечённого из грудины при помощи костномозговой иглы. Получению хромосомных препаратов из костного мозга бедренных костей у крупных животных часто мешает наличие жира.
Пунктат костного мозга (0,51 мл) помещают в центрифужные пробирки, содержащие 9 мл питательной среды 199, 1 мл готовой сыворотки крупного рогатого скота, и инкубируют от 1 до 5 час. при температуре 37°. Для этой цели можно использовать термостат, водяную баню или просто термос с тёплой водой. За 40 мин. до конца инкубации вводят 0,2 мл 0,004%ного раствора колхицина. По окончании инкубации клетки осаждают центрифугированием в течение 5 мин. при 800 об/мин. Надосадочную жидкость сливают, а осадок разбивается сильной струёй гипотонического раствора (0,56%ный хлористый калий), выдуваемого из шприца или пипетки. Гипотоническая обработка и все дальнейшие процедуры проводятся так же, как и в случае приготовления хромосомных препаратов из костного мозга животных, которым до забоя вводили колхицин (см. выше).
Хромосомные препараты из эмбрионального материала, как правило, получают при введении его в культуру. Но если нет условий для культуры тканей, то можно получить хромосомные препараты непосредственно из эмбриональной ткани.
Активно делящиеся ткани эмбрионов (печень, селезёнка и др.) или целый эмбрион на ранних стадиях развития помещают в центрифужную пробирку, содержащую питательную среду Игла с глутамином (или среду 199), и ресуспензируют медицинским шприцем с толстой иглой. Клетки остаются в суспензии при температуре 37°С в течение 11,5 час. Также за 40 мин. до конца
9
инкубирования вводят 0,2 мл 0,004 %ного раствора колхицина.
Затем клетки осаждают центрифугированием и всю дальнейшую обработку проводят так же, как и в случае приготовления хромосомных препаратов из клеток костного мозга.
Хромосомные препараты из культуры лейкоцитов периферической крови
Кратко методика сводится к тому, что плазму крови с лейкоцитами смешивают с питательной средой и добавляют фитогемагглютинип (ФГА), благодаря митогенетическому действию которого через 24 часа в культуре появляются первые митозы. Наибольшее количество делящихся клеток, как правило, наблюдается через 72 часа после введения в культуру (Moorhead et al., 1960). В зависимости от количества взятой крови различают макро и микрометод.
Макрометод
1. Заготавливают стерильные пробирки, содержащие 0,5 мл рабочего раствора гепарина (10 мл раствора Хенкса +0,5 мл раствора гепарина). Пробирку закрывают стерильной пенициллиновой пробкой. Её края заклеивают лейкопластырем.
2. Шприц, прокипяченный в течение 40 мин., промыть чистым гепарином и в него брать кровь.
3. Кровь берут из яремной вены животного шприцем и переливают в пробирку с гепарином, проколов пенициллиновую пробку иглой.
4. Ставят пробирки в холодильник при +4°С на 30 мин. Если за это время эритроциты не осели, то в стерильных условиях добавляют 10%ный раствор желатины в соотношении 3:1 (3 части крови: 1 часть желатины). Эту и ряд последующих процедур проводят в стерильном боксе, который был облучён бактерицидными лампами в течение 1,5 час. перед постановкой культуры.
5. После того, как эритроциты осядут, плазму отсасывают мерной пипеткой.
6. Полученную плазму смешивают с питательной средой (среда 199 или Игла с глутамином) в соотношении 1 часть плазмы и 3 части питательной среды.
7. На 10 мл этой смеси добавляют 0,2 мл фитогемагглютининаМ фирмы Wellcome (или Difco) или 0,02 мл фитоге
10
магглютининаР фирмы Difco. Добавляют антибиотики (пенициллин из расчёта 100 ед. на 1 мл, стрептомицин 50 ед. на 1 мл).
8. Полученную взвесь клеток можно культивировать в чашках Корреля, в матрасах, в плоскодонных колбах или в пенициллиновых флаконах (по 1,5 мл на флакон). Взвесь клеток разливают по флаконам, закрывают резиновыми пробками и оставляют в термостате при 37°С на 72 часа. Часть плазмы можно сохранить в холодильнике и ввести в культуру спустя 34 дня, когда станут известны результаты первой культуры.
9. За 11,5 часа до фиксации в культуру вводят подогретый до 37°С раствор колхицина, содержащий 20 гамм на 1 мл воды (0,002%ный раствор), из расчёта 0,5 гамм на 1 мл среды1.
10. После 1 часа инкубации с колхицином культуру разливают по центрифужным пробиркам и центрифугируют 58 мин. при 1000 об/мин (режим центрифугирования при всей последующей обработке сохраняется примерно таким же).
11. Удалить надосадочпую жидкость, а к осадку добавить тёплый (37°С) раствор Хенкса, взболтать постукиванием пальца по пробирке и отцентрифугировать.
12. Надосадочную жидкость слить, а осадок разрыхлить и залить тёплым (37°) гипотоническим раствором хлористого калия (0,5%ный). Для получения хорошего разброса хромосом в метафазных пластинках необходимо, чтобы пребывание клеток в гипотоническом растворе (включая цептрифугирование) продолжалось не более 16 мин.
13. Надосадочную жидкость слить, оставить немпого гипотонического раствора на дне пробирки. Осадок взболтать. Фиксировать смесью метилового спирта с ледяной уксусной кислотой (3:1). Хорошо фиксатор подавать под напором, при этом разбиваются все кусочки. Дать немного постоять (34 мин.) и центрифугировать.
14. Надосадочную жидкость убрать пипеткой, осадок ресуспензировать, влить новую порцию фиксатора и вновь центрифугировать. Так повторить 23 раза. В итоге осадок должен быть очень белым. Если он еще окрашен, то вновь сменить фиксатор.
1 В этой и последующих процедурах не требуется соблюдать стерильность.
Дальнейшее приготовление хромосомных препаратов проводится так, как описано в разделе «Метод высушенных препаратов».
11
Микрометод
Микрометод применяется в тех случаях, когда в распоряжении исследователя имеется небольшое количество крови.
В туберкулиновый шприц, предварительно смоченный гепарином, набирается кровь из пальца, уха, хвостовой вены животного, либо както иначе. Эта кровь вводится в заранее подготовленные стерильные центрифужные пробирки, содержащие 6 мл питательной среды (среда 199 или Игла с глутамином), 1 мл сыворотки крупного рогатого скота без консерванта и фитогемагглютинин (из расчёта 0,2 мл на 10 мл среды). Обязательно добавлять антибиотики, так как малое количество крови обычно не удаётся взять стерильно. Содержимое пробирки тщательно перемешивается и пробирки помещают под углом 45° в термостат при температуре 37°С. Инкубируют микрокультуру 35 суток. Введение колхицина и вся последующая обработка ведутся так же, как и при макрокультуре (см. выше).
Хромосомные препараты из культуры эмбриональных фибробластов
Эмбрион извлекается по возможности стерильно и переносится в раствор Хенкса, содержащий пенициллин и стрептомицин в концентрации 5001000 ед/мл. Материал может храниться в холодильнике при 4°С до введения его в культуру в течение трёх суток.
Практически любая эмбриональная ткань пригодна для культивирования и цитологического исследования. Чаще всего цитогенетиками используется культура эмбриональных фибробластов.
Все процедуры проводятся с соблюдением правил стерильности в боксе, предварительно облучённом бактерицидными лампами в течение 1,5 час.
1. В чашке Петри со стерильным раствором Хенкса отделить от эмбрионов кусочки кожномышечной ткани и тщательно очистить их от сгустков крови.
2. Кусочки переложить во вторую чашку Петри и процедуру очистки повторить.
3. Все очищенные кусочки собрать в одном стакане со свежим раствором Хенкса и тщательно их измельчить ножницами до консистенции фарша.
12 12
4. Материал перенести в стерильную колбу, туда налить холодный 0,25%ный раствор трипсина, колбу плотно закрыть стерильной резиновой пробкой или фольгой и поставить в термостат (или водяную баню) при температуре 37° на 1 час.
5. Содержимое колбы перелить в центрифужные пробирки и центрифугировать 5 мин. при 1000 об/мин.
6. Надосадочная жидкость сливается, а осадок с небольшим количеством оставшейся жидкости выливается в небольшую плоскодонную колбу, куда добавляется питательная смесь, содержащая 50% среды Игла с глутамином, 30% гидролизата лактальбумина и 20% сыворотки крупного рогатого скота.
7. Эта взвесь ставится на магнитную мешалку на 10 мин.
8. Фильтруется в мерный флакон через стеклянный фильтр G1 (можно через воронку с несколькими слоями марли вместо фильтра). В оставшийся на дне осадок вновь наливается питательная среда и колба вновь ставится на магнитную мешалку на 10 мин., после чего жидкость фильтруется в тот же мерный флакон.
9. Стерильной пипеткой взять каплю суспензии и в камере Горяева подсчитать количество клеток, приходящихся в среднем на один квадрат из десяти просчитанных. Далее высчитывают, во сколько раз следует разбавить суспензию средой, чтобы в итоге на один квадрат камеры Горяева приходилась только одна клетка.
10. Взвесь выливается в матрас или плоскодонные колбы, закрывается стерильной резиновой пробкой и сверху фольгой и помещается в термостат при температуре 37° на 4872 часа. Митотические деления большинства клеток начинаются через 48 час. от начала инкубации и почти прекращаются через 72 часа.
11. За 12 часа до окончания инкубации добавляется подогретый водный рабочий раствор колхицина из расчёта 0,5 гаммы на 1 мл среды (рабочий раствор колхицина содержит 20 гамм в 1 мл). В дальнейших операциях соблюдения стерильности не требуется.
12. По окончании инкубации слить среду и налить немного холодного трипсина, который тут же вылить. Подождать немного, чтобы клетки начали сползать со стекла, и влить раствор Хенкса. Тщательно встряхнуть несколько раз, чтобы смыть все клетки.
13. Взвесь разлить по центрифужным пробиркам и центрифугировать 58 мин. при 1000 об/мин.
14. Слить или отсосать надосадочную жидкость, осадок
13
взболтать постукиванием пальца и налить тёплый (37°С) раствор 1%ного цитрата натрия (трехзамещенный лимоннокислый натрий).
15. Содержимое пробирок взболтать и поставить в термостат или водяную баню при температуре 37° на 2030 мин. По окончании инкубации пробирки центрифугируют.
16. Надосадочную жидкость удаляют, а осадок с небольшим количеством оставшейся жидкости разбивают лёгким постукиванием пальцев по пробирке и наливают охлаждённый фиксатор, состоящий из метилового спирта и ледяной уксусной кислоты (3:1).
17. После центрифугирования надосадочную жидкость удаляют, осадок разбивают и заливают новым фиксатором, состоящим из метилового спирта и ледяной уксусной кислоты, но в соотношении 2:1. Общая продолжительность фиксации 1 час или более.
Дальнейшее приготовление хромосомных препаратов ведётся по обычной методике «высушенных препаратов».
Приготовление препаратов мейотических хромосом
В настоящее время разработаны и успешно применяются несколько методов приготовления хромосомных препаратов из семенников млекопитающих. Мейотические хромосомы исследуют как на давленых тотальных препаратах половых желёз, так и на препаратах, полученных путём высушивания взвеси клеток, нанесённых на предметное стекло.
В настоящее время явное предпочтение отдают второму методу, так как метод давленых препаратов имеет ряд существенных недостатков. Ниже мы приводим две наиболее популярные методики, принципиальное различие которых заключается в способе выделения клеток из генеративной ткани.
Большая часть исследований по мейозу у млекопитающих, выполненных в последние годы, базируется на препаратах, полученных по методике Ивенса и соавторов (Evans et al., 1964).
14
1. Семенники помещают в небольшое количество 2,2%ного раствора трёхзамещённого цитрата натрия при комнатной температуре. Надрезают тунику и семенные канальцы выпускают в раствор для удаления сопутствующего жира и интерстициальной ткани. После этих операций семенные канальцы переносят в свежий раствор цитрата натрия такой же концен-
14
трации.
2. Держа массу семенных канальцев глазным пинцетом, другим пинцетом осторожно, чтобы не порвать канальцы, выдавливают содержимое канальцев в раствор. Полученную клеточную суспензию переносят в пробирку, добавляют немного (около 3 мл) свежего цитрата и центрифугируют 30 сек. при 500 об/мин. Надосадочную жидкость переливают в новую центрифужную пробирку и центрифугируют 5 мин. при 500 об/мин. При таком режиме центрифугирования спермии остаются в суспензии, а сперматоциты осаждаются на дно пробирки.
3. Надосадочную жидкость сливают, а осадок ресуспензируют в 3 мл 1%ного раствора цитрата натрия лёгким постукиванием пальцев по стенке пробирки. В течение 712 мин. (в зависимости от того, с семенниками какого вида животного имеют дело) клетки выдерживаются в гипотоническом растворе при комнатной температуре (длительность гипотонической обработки подбирается эмпирически). Так, по данным А.И. Козловского, пребывание клеток в гипотоническом растворе в течение 12 мин. полностью разрушает сперматоциты у обыкновенной бурозубки и оптимальным для этого вида является гипотоническое воздействие продолжительностью 710 мин.
4. Клетки осаждают 5минутным центрифугированием при 500 об/мин. Надосадочную жидкость осторожно удаляют, а осадок сразу же ресуспензируют лёгким встряхиванием пробирки.
5. Осторожно, по каплям, все время, взбалтывая и постукивая пальцем по пробирке, вливают фиксатор, состоящий из 1 части ледяной уксусной кислоты, 3 частей метилового спирта или абсолютного этилового спирта и хлороформа (1 часть на 40 частей фиксатора). Количество фиксатора около 23 мл.
6. После центрифугирования осадок ресуспензируют в свежем фиксаторе и оставляют в нём на 10 мин. Затем следует ещё одно центрифугирование и замена фиксатора.
15
7. На согретое под лампой абсолютно чистое предметное стекло накапать 23 капли суспензии и после полного растекания каждой капли подуть на стекло. Дать препарату подсохнуть. Эта методика даёт возможность получать хорошие препараты мейотических хромосом из семенников млекопитающих, однако не позволяет исследовать некоторые стадии мейоза, а также метафазы. Во время приготовления из нефиксированных семенных канальцев взвеси изолированных клеток и под действием гипо -
15
тонии теряется большинство сперматогоний на стадии метафазы, а при неоднократном центрифугировании и смене фиксатора происходит потеря сперматоцитов на стадии метафазы 2го деления созревания (Дыбан, 1970).
Принципиальная особенность методики, описываемой ниже (Meredith, 1969), состоит в иной последовательности обработки ткани. Кроме того, оказываются излишними такие операции, как приготовление из нефиксированных семенных канальцев взвеси изолированпых клеток, центрифугирование, что устраняет потери клеток в ходе приготовления препаратов.
1. Около 100 мг семенника помещают в свежеприготовленный 1%ный раствор цитрата натрия, отмывают жир и интерстициальную ткань и удаляют тунику.
2. Отмытые канальцы переносят в свежий 1%ный раствор цитрата натрия и осторожно распутывают, чтобы обеспечить хорошее проникновение гипотонического раствора. Необходимо следить, чтобы не произошло разрыва канальцев.
3. После этой обработки происходит помутнение раствора цитрата и материал следует перенести для дальнейшей гипотонической обработки в третью смену 1%ного раствора цитрата натрия. Объем раствора цитрата натрия должен примерно в 20 раз превышать объем ткани.
4. Общее время гипотонической обработки варьирует для разных видов млекопитающих. Для семенных канальцев крыс, сирийских хомячков и кроликов достаточно восьмиминутного пребывания в гипотоническом растворе. Для тканей морской свинки и белой мыши гипотоническое воздействие увеличивается до 12 мин. Следует помнить, что гипотонический раствор должен быть комнатной температуры, около 1820°.
16
5. Во время гипотонической обработки канальцы несколько раз передвигают пинцетом из одного участка чашки Петри в другой, а затем переносят в фиксатор, приготовленный из трёх частей этилового спирта и одной части ледяной уксусной кислоты. Фиксация проводится в стеклянном бюксе с крышкой, объем фиксатора около 20 мл.
6. Для хорошей фиксации вполне достаточно 15 мин., после чего можно готовить препараты. Однако если нет возможности немедленно сделать препараты, то канальцы можно сохранить в фиксаторе несколько педель при температуре от 0 до +4°С.
7. Для приготовления препаратов несколько миллилитров фиксатора вместе с небольшим количеством канальцев поме
16
щают в маленькую чашку Петри. При помощи пары препаровальных игл канальцы измельчают, отделяют их от фиксатора и переносят в 60%ную уксусную кислоту, налитую в маленькую агглютинационную пробирку (около 0,5 мл). Здесь канальцы быстро становятся прозрачными, так как сперматогониальные клетки выпадают в суспензию. Некоторое постукивание по стенке пробирки даёт возможность получить однородную взвесь.
8. Однородную суспензию клеток набирают в микропипетку и одну каплю наносят на обезжиренное предметное стекло, предварительно нагретое до 60 °С.. Тотчас же эту каплю вновь вбирают в микропипетку и переносят на другое место этого же стекла. Операция повторяется 45 раз для каждой используемой капли. Процесс может длиться и дольше, пока нужное количество клеток не будет нанесено на стекло. После использования нескольких капель суспензия выливается, новое стекло заселяют клетками, полученными из свежей ткани. Принцип, на котором основано получение препаратов, заключается в том, что суспензированные клетки мигрируют к периферии с каплей и при быстром отсасывании капли микропипеткой происходит подсыхание части клеток тонким слоем, а не скученно, что способствует хорошему разбросу хромосом. Желательно готовить маленькие порции материала, так как после 5 мин. пребывания в 60%ной уксусной кислоте клетки начинают разрушаться. Используя этот метод, можно наблюдать различные стадии сперматогенеза. Принципиально сходная, но более трудоемкая методика приготовления как мейотических, так и митотических препаратов из семенников млекопитающих описана А.П. Дыбаном (1970).
17
II РАЗЛИЧНЫЕ СПОСОБЫ ОКРАСКИ ХРОМОСОМНЫХ ПРЕПАРАТОВ
Получение хорошо окрашенных хромосомных препаратов представляет собой один из важнейших этапов хромосомного анализа. При правильной окраске большинством красителей хромосомы становятся интенсивного краснофиолетового цвета, а под микроскопом с зелёным фильтром, которым рекомендуется пользоваться при просмотре и фотографировании препаратов, выглядят черными, с четкими неразмытыми краями и хорошо различимыми хроматидами.
17
Окраска азурэозином
В отдельных флаконах готовятся исходные растворы красителей: 1) 100 мг сухого азураII на 100 мл дистиллированной воды; 2) 100 мг сухого водорастворимого эозина на 100 мл воды. При хранении этих растворов происходит их «вызревание», поэтому краски, приготовленные заранее, красят лучше, чем свежие. Непосредственно перед окраской готовится рабочий раствор: смешиваются 2 части исходного раствора эозина, 3 части исходного раствора азура и 5 частей дистиллированной воды. Для лучшего окрашивания в готовый краситель добавляется 0,51 мл (на 100 мл красителя) 0,1%ного раствора углекислого натрия так, чтобы реакция красителя была близкой к нейтральной. Предметные стекла помещаются в стаканчики с краской и выдерживаются, в зависимости от качества красителей, от 5 до 20 мин. После этого стекла споласкиваются в дистиллированной воде, высушиваются и проводятся сначала через смесь бутилового спирта и ксилола (1:2), а затем через чистый ксилол. После этого на стекло наносится капля канадского бальзама и оно закрывается покровным стеклом.
Покровные стекла кипятят в мыльном растворе, отмывают горячей проточной, а затем дистиллированной водой и кладут в смесь спирта с эфиром или в чистый спирт. Затем каждое стекло тщательно вытирается чистой, сложенной вчетверо марлей, после чего им можно накрывать препарат.
18
Для окраски препаратов можно пользоваться также готовым красителем Гимза (азурэозин по Романовскому). При этом на 100 мл дистиллированной воды берётся 5 мл готового раствора Гимза и 23 мл 0,1%ного раствора углекислого натрия. Препарат погружается в краску на 510 мин., затем споласкивается дистиллированной водой, высушивается, проводится через чистый ксилол и заключается в бальзам.
Азурэозином одинаково хорошо окрашиваются как митотические, так и мейотические хромосомные препараты, приготовленные из клеточной суспензии с выжиганием фиксатора и без выжигания.
18
Окраска орсеином
Готовится 2%ный раствор ацеторсеина. Для этого 2 г сухого орсеина растворяют в 45 мл горячей ледяной уксусной кислоты и после охлаждения добавляют 55 мл дистиллированной воды. Можно готовить орсеин не на 45%ной уксусной, а на 60%ной пропионовой или молочной кислоте, или на смесях молочной и уксусной кислот (лактацеторсеин). В последнем случае смешиваются равные части 60% ной молочной и ледяной уксусной кислот, подогреваются и в этой жидкости растворяется орсеин (из расчета 2 г на 100 мл смеси кислот). Затем свежепрофильтрованный раствор орсеина капают на предметное стекло и покрывают покровным стеклом. Излишек орсеина удаляют фильтровальной бумагой и по краю покровного стекла заклеивают его горячим парафином (или смесью воска с парафином). В таком виде стекла помещаются в камеру с парами уксусной кислоты (например, в чашку Петри, на дно которой положена фильтровальная бумага, смоченная уксусной кислотой) и ставятся в холодильник на 23 суток. Затем покровное стекло вместе с парафином осторожно удаляется бритвой, и препараты проводятся последовательно через 45%ную уксусную кислоту, бутиловый спирт и два ксилола, после чего заключаются в бальзам.
19
Хранить раствор орсеина следует в темной бутылке с притертой пробкой, желательно на холоду (при 4°С можно хранить несколько месяцев), а фильтровать следует непосредственно перед употреблением. Лучше всего окрашивает хромосомы орсеин фирмы Мерк (Merck, Darmstatd, Orcein 7091) или фирмы Герр (Т. Gurr, London). Препараты, приготовленные с выжиганием фиксатора, окрашиваются орсеином плохо.
Окраска по Фёльгену
1 г фуксина кипятят в течение 5 мин. в 200 мл дистиллированной воды, затем охлаждают в проточной воде под краном и фильтруют через бумажный фильтр. К фильтрату добавляют 20 мл 1%ного раствора соляной кислоты и 1 г бисульфита натрия. Краску хранят в холодильнике при температуре +(23)°С. Препараты окрашивают в течение 1 часа. Перед окраской препараты должны быть подвергнуты гидролизу в 1%ном растворе соляной кислоты в течение 12 мин. в термостате при 58°С. После
19
гидролиза препараты промывают 2 раза в дистиллированной воде и приступают к окраске.
Окраска гематоксилином по Эрлиху
Смешать: 2 г гематоксилина Эрлиха, 100 мл 95%ного этилового спирта, 100 мл дистиллированной воды, 100 мл глицерина, 3 г калийных квасцов и 10 мл ледяной уксусной кислоты. Смесь держать две недели на свету.
После гидролиза (см. окраску по Фёльгену), промывки под краном и в дистиллированной воде препарат опускают в краску и держат от 10 до 30 мин. Если гематоксилин старый, то препараты можно красить в течение 10 мин. Далее следует промывка дистиллированной водой и дифференцирование в спирте с соляной кислотой в течение 12 мин. (на 100 мл 70%ного спирта около 1 мл 1%ного раствора соляной кислоты). После этого препараты промывают в проточной воде 2030 мин. Если окрашивают давленые препараты хромосом, то после промывки следует проводка через спирты и ксилол:
1. 96%ный спирт (1) 1 мин.
2. 96%ный спирт (2) 1 мин.
3. Абсолютный спирт (1) 1 мин.
4. Абсолютный спирт (2) 1 мин.
5. Ксилол (1) 1 мин.
6. Ксилол (2) 1 мин. (можно держать и 23 дня).
После проводки на препарат наносится капля канадского бальзама и закрывается чистым тонким покровным стеклом.
20
Дифференциальная окраска хромосом
Методы дифференциальной окраски хромосом человека и млекопитающих, широко разрабатываемые в последние годы цитологами всего мира, открывают принципиально новые возможности в цитогенетике животных. Суть этих методов в том, что хромосомы, предварительно обработанные различными веществами, начинают связывать красители (флуоресцентные или краситель Гимза) дифференцированно по длине каждой хромосомы. Окрашенные таким образом хромосомы выглядят как бы «полосатыми» (banding), причём эти полосы различны по ширине и интенсивности, а характер поперечной исчерченности оказывается специфическим для каждой пары хромосом (см. рис.
20
3).
По характеру получаемой картины исчерченности и по типу обработки хромосом методы дифференциальной окраски принято условно разделять на несколько групп:
1) окраска с применением флуоресцентных красителей, в международной терминологии Qbands (Qполосы) (Zech, 1969; Casperson et al., 1970; Lin et al, 1971, и др.);
2) окраска, выявляющая конститутивный гетерохроматин Cbands (Сполосы) (Pardue, Gаll, 1970; Arrighi, Hsu, 1971, и др.);
3) окраска красителем Гимза, с различными предобработками хромосом Gbands (Gполосы) (Evans et al., 1971; Seabright, 1971; Schnedl, 1971, и др.).
Число методик каждого класса велико и непрерывно растёт.
Следует заметить, что расположение светящихся дисков в хромосомах, окрашенных флуоресцентными красителями, как правило, совпадает с расположением темных дисков, получаемых при окраске хромосом красителем Гимза, с той разницей, что флуоресцентные красители выявляют более грубый рисунок исчерченности хромосом. Создаётся такое впечатление, что различные методы получения Gполос (окраской по Гимза) дают если не совершенно сходные, то вполне сопоставимые результаты.
Окраска, выявляющая конститутивный гетерохроматин (Сполосы), в большинстве случаев обнаруживает гетерохроматиновые блоки, локализованные в центромерных и теломерных районах хромосом, но иногда выявляются гетерохроматиновые области в различных участках хромосомных плеч или даже полностью гетерохроматические хромосомы.
21
Молекулярные механизмы, вызывающие образование специфической поперечной исчерченности хромосом, ещё совершенно не ясны. Предполагается лишь, что эти явления связаны с процессами денатурации белковых или ДНКовых структур хромосом при различных обработках (солями, трипсином, растворами мочевины и т. д.) и обратной частичной их ренатурации. Некоторые исследователи связывают дифференциальную окраску с неравномерным расположением по длине хромосом участков репетированной ДНК (т. е. ДНК с повторяющимися последовательностями). Однако пока все многочисленные гипотезы такого рода остаются в существенной степени спекулятивными.
21
Тем не менее, тот факт, что характер поперечной исчерченности хромосом специфичен для каждой хромосомной пары, почти не зависит от степени спирализации хромосом (в сильно спирализованных хромосомах неразличимы некоторые тонкие диски), а также сохраняется в перестроенных участках хромосом, позволяет, вопервых, строго идентифицировать все хромосомные пары в кариотипе и, вовторых, проследить хромосомные перестройки, сравнивая при этом как кариотипы одного вида, так и разных видов родственных форм животных и выявляя гомологичные и перестроенные хромосомы. Все это открывает возможности более глубокого по сравнению с традиционными методами кариотаксономического анализа изучения эволюционных соотношений кариотипов, в частности, в тех случаях, когда непосредственный гибридологический анализ невозможен изза сравнительно отдалённого филогенетического родства сопоставляемых форм.
Поскольку методы окраски предварительно обработанных хромосом красителем Гимза позволяют выявлять наиболее тонкую картину хромосомной исчерченности и дают лучшие результаты, приведём одну из этих методик, разработанную С.И. Раджабли (Раджабли, Крюкова, 1973).
22
Цитологические препараты из клеток костного мозга или культуры тканей, приготовленные по обычным методикам с применением цитратной гипотонии и техники выжигания фиксатора, на 1520 сек. опускали в 0,25%ный раствор трипсина, нагретый до 30°С. После этого препараты споласкивали в 2×SSCбуфере (в 1 л дистиллированной воды растворить 17,53 г хлористого натрия и 8,82 г цитрата патрия), а затем помещали в термостат в свежем растворе этого буфера, где выдерживали 1 час при 62° С. После этого препараты окрашивались красителем Гимза (1 мл основного красителя Гимза на 50 мл дистиллированной воды при рН 6,87,0) 510 мин., ополаскивались в дистиллированной воде и высушивались. Приготовленные препараты перед окраской желательно хранить не больше одного месяца, в противном случае качество дифференциальной окраски ухудшается.
22
III
АНАЛИЗ ХРОМОСОМНЫ
Х ПРЕПАРАТОВ
Поиск и фотографирование метафазных пластинок
Для визуального анализа хромосомных препаратов пригодны микроскопы любого типа с иммерсионными объективами 90× или 100×. Обычно предметное стекло просматривается полностью «челноком». Поиск метафазных пластинок ведут при малом увеличении микроскопа, порядка 100120. Такого увеличения вполне достаточно не только для обнаружения метафазной пластинки, но при некотором навыке исследователя и для оценки её качества. Весь дальнейший анализ метафазной пластинки возможен только с использованием иммерсионных объективов. Если хромосомы лежат очень скученно, то пластинка не пригодна для анализа. В первое время, пока не приобретён необходимый опыт, следует ставить под иммерсионное увеличение все метафазные пластинки, встреченные на стекле. Местоположение метафазных пластинок отмечают по осям координат на предметном столике или на специальной координационной сетке, а данные записывают в регистрационный журнал. В журнале отмечают также число хромосом, подсчитанное на анализируемой пластинке. Одновременно схематично зарисовывают метафазную пластинку и отмечают индивидуальные особенности хромосом: соотношение плеч, спутники, вторичные перетяжки.
23
Каким же требованиям должна отвечать метафазная пластинка, пригодная для анализа? Желательно, чтобы все хромосомы лежали отдельно друг от друга (рис. 1).
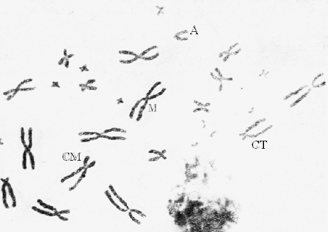
Рис. 1. Метафазная пластинка из клеток костного мозга самца джунгарского хомячка:
М – метацентрическая хромосома; СМ – субметацентрическая хромосома; СT – субтелоцентрическая хромосома; А – акроцентрическая хромосома.
Однако если некоторые хромосомы частично накладываются, то и такая пластинка может быть использована. Совершенно обязательно, чтобы все хромосомы лежали в одной плоскости. Форма метафазной пластинки должна быть по периферии округлой или овальной, но в последнем случае ее большой диаметр должен составлять не более двух малых. Слишком сильный разброс хромосом обычно сопровождается «утерей» некоторых из них, и такие пластинки для анализа непригодны.
– 24 –
Хромосомы не должны быть слишком спирализованы, иначе невозможно правильно определить форму мелких хромосом. На одном препарате, в зависимости от митотической активности ткани изучаемого животного, можно встретить от единиц до десятков метафазных пластинок. Чтобы составить представление о кариотипе исследуемого вида, необходимо просмотреть достаточно большое число метафазных пластинок – порядка 2050, а иногда и больше.
Хромосомные препараты можно с успехом фотографировать под микроскопом с микрофотонасадками.
Описание формы хромосом и кариотипирование
В метафазе хромосома состоит из двух нитей, которые интенсивно окрашиваются основными красителями, а также дают положительную реакцию по Фёльгену. Эти нити, называемые хроматидами, расположены параллельно и соединены между собой только в одной точке первичной перетяжки или центромеры (см. рис. 1). На интенсивно окрашенной метафазной хромосоме центромера выделяется как участок непрокрашивающийся. Положение центромеры строго постоянно для каждой хромосомы и является определяющим морфологическим признаком хромосомы. Центромера имеет сложную структуру и функционально весьма важна. В частности, с ней связаны нити веретена, обеспечивающие движение хромосомы к полюсам деления клетки.
Форма хромосомы определяется исключительно положением центромеры. Участок хроматиды от её конца до центромеры называют плечом хромосомы. Оба плеча хромосомы могут быть приблизительно равны или же весьма отличаться по длине.
Если форма хромосомы оценивается визуально без промеров, то желательно пользоваться следующей грубой классификацией, относя каждую хромосому к одному из трёх морфоло—
24
гических типов (рис. 1):
1. Метацептрические хромосомы – плечи хромосом почти равной длины.
2. Субметацентрические хромосомы – плечи хромосом явно неравной длины.
3. Акроцентрические хромосомы – центромера расположена очень близко к концу хромосомы.
– 25 –
В качестве образца можно рекомендовать классификацию хромосом человека, разработанную на Денверской и Лондонской конференциях (ПрокофьеваБельговская, Гиндилис, 1965).
Акроцентрические хромосомы условно считают одноплечими, а остальные – двуплечими. Очень часто подсчитывают число плеч хромосом, или основное число NF (от французского «nombre fondamental» – Matthey, 1949). В NF входит число плеч аутосом и двух Ххромосом. Иногда подсчитывают только число плеч аутосом (исключают плечи Ххромосом).
Леван, Фредга и Сандберг разработали более подробную классификацию формы хромосом, основанную на соотношении большего и меньшего плеч хромосом (Levan et al., 1964). Они выделили четыре типа хромосом:
1. Метацеитрические хромосомы – соотношение плеч от 1 до 1,7.
2. Субметацентрические хромосомы – соотношение плеч от 1,7 до 3.
3. Субтелоцептрические хромосомы – соотношение плеч от 3 до 7.
4. Телоцентрические хромосомы – соотношение плеч больше 7.
Пользоваться этой классификацией имеет смысл лишь в том случае, если промерены хромосомы нескольких метафазных пластинок и притом в одинаковой степени спирализованные (см. ниже). Дело в том, что спирализация не только укорачивает хромосому в целом, но и несколько меняет соотношение плеч, так как длинное плечо абсолютно и относительно укорачивается сильнее короткого. Поэтому субметацентрическая хромосома при сильной спирализации может выглядеть метацентрической и т.п. Не следует прибегать к этой классификации, если форма хромосом оценивается визуально без промеров.
Следует добавить, что термин «телоцептрическая» хромосома в своём точном значении обозначает хромосому с концевым положением центромеры. Когда выяснилось, что таких хромо—
25
сом практически нет, в обиход вошёл термин «акроцентрическая» хромосома, обозначающая хромосому с очень коротким вторым плечом. Действительно, в настоящее время ни в одном случае хромосому млекопитающих нельзя с уверенностью назвать телоцентрической в точном значении этого термина.
26
Совокупность хромосом организма, т.е. его диплоидный набор, характеризующийся определённым числом, формой и величиной хромосом, называют кариотипом. В более узком смысле кариотипом называют также определённым образом систематизированный набор хромосом единичной клетки. Такой кариотип получают, вырезав из фотографии метафазной пластинки отдельные хромосомы и разложив их по величине и форме (рис. 2).
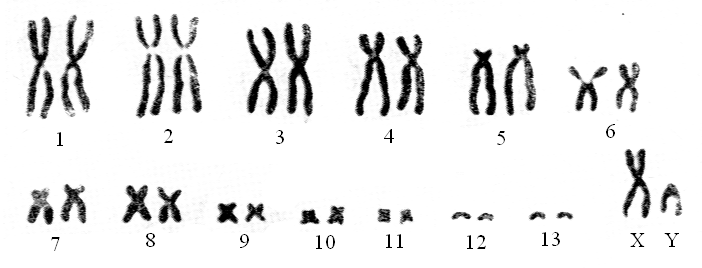
Рис. 2. Кариотип самца джунгарского хомячка X и Y – половые хромосомы.
Если все хромосомы лежат отдельно, то достаточно с одного негатива сделать два отпечатка – один пойдет для вырезания хромосом, а другой останется неразрезанным, для контроля. Если хромосомы налегают друг на друга, то приходится делать большее число отпечатков или же печатать отдельные фрагменты тех участков метафазной пластинки, где встречаются наложения.
Хромосомный набор соматической клетки млекопитающих диплоидный (2n) и состоит из двух гаплоидных наборов (n), один из которых вносится в зиготу женской гаметой, а другой – мужской гаметой. Поэтому хромосомы набора парные, т.е. каждая хромосома имеет своего морфологического двойника, или гомолога (гомологичные хромосомы). Одна пара хромосом у млекопитающих имеет непосредственное отношение к определению пола и называется половыми хромосомами, или гетеро-хромосомами, так как у самцов хромосомы этой пары различаются между собой по величине или форме (ХХ-хромосомы самок и XY- хромосомы самцов) (см. рис. 2).
Гомологичные пары подбираются по принципу подобия, с учетом индивидуальных морфологических особенностей (размеры, положение центромеры, наличие спутников, вторичных перетяжек, расположение и количество полос при дифференциальной окраске по Гимза, особенности свечения при флуоро-хромировании). Наиболее правильно удается составить гомологичные пары после дифференциальной окраски хромосом (рис. 3).
Идентифицировать половые хромосомы возможно только на метафазных пластинках самцов и то не во всех случаях.
Разложенные по парам хромосомы наклеивают на лист ватмана резиновым клеем. Если возникнет необходимость поменять хромосомы местами, то их можно будет легко отклеить. Расположить пары хромосом на листе можно в несколько рядов по принципу убывающих по величине или же по морфологическим типам (метацентрические, субметацентрические и т. д.). Если гетерохромосомы легко идентифицируются, то их, как правило, помещают чуть в стороне от аутосомных пар. Чтобы иметь дубликат кариотипа, оригинал следует переснять.
Кариограммный анализ
Для определения хромосомных характеристик и более точной идентификации гомологичных хромосом в некоторых случаях прибегают к кариограммному анализу. Для этого подбирают несколько метафазных пластинок одной или разных особей изучаемого вида, в зависимости от цели исследования.
– 28 –
Длина хромосомы закономерно изменяется на разных стадиях деления клетки. Она максимальна в интерфазе, но начиная с профазы хромосомная нить спирализуется и сильно укорачивается. Одновременно увеличивается диаметр хроматиды и в профазе она становится различимой под световым микроскопом. –
27
Процесс спирализации продолжается в метафазе и анафазе, когда хромосома достигает минимальной длины. В метафазе, по сравнению с профазой, хромосома укорачивается более чем в 10 раз. Велико также различие длины хромосомы в ранней и поздней метафазе. Резко сокращаются в длину хромосомы под действием колхицина (рис. 4).

Метафазные пластинки до недавних пор обычно подбирались по степени укорочения (спирализации) хромосом, которая не должна внутри выборки варьировать в широких пределах. Спирализация хромосом оценивалась индексом спирализации, который при кариограммном анализе хромосом человека (Гиндилис, 1966) и растений (Павулсоне и др., 1970) определяется как отношение (в %%) суммарной длины двух самых мелких пар мета и субметацентрических хромосом к суммарной длине самых крупных пар хромосом такой же формы.
Специальными исследованиями недавно установлено, что индекс спирализации не всегда отражает истинную спирализацию хромосом (Павулсоне, Иорданский, 1971).
– 28 –
Поэтому было предложено отбирать кариотипы для анализа по суммарной длине одной или нескольких пар хромосом. На примере кариограммного анализа двух видов лука С. А. Павулсоне и А. Б. Иорданский (1971) показали, что длина нескольких хромосом является достаточной для характеристики степени спирализации всего хромосомного набора и может быть использована в качестве более достоверного критерия кариотипов для создания однородной выборки. Для кариограммного анализа подбирают не менее 10 метафазных пластинок сходной спира–
лизации и приступают к измерению хромосом. Унифицированная система измерений хромосом отсутствует, поэтому промеряются они разными способами. Существует способ измерения длины плеч хромосом под микроскопом с помощью окулярмикрометра как в относительных единицах, так и в микронах. Более распространен метод измерений по предварительно сделанным рисункам хромосом или по микрофотографиям. Метафазные пластинки фотографируют, после чего негативы при постоянном увеличении проецируют через фотоувеличитель на лист бумаги и все хромосомы очень тщательно зарисовывают. Затем по рисункам измеряют плечи хромосом кронциркулем с точностью до десятых долей миллиметра. Процедура подобных измерений подробно изложена в работах А. А. Прокофьевой-Бельговской и В.М. Гиндилиса (1965), с той лишь разницей, что эти авторы измеряют хромосомы на микрофотографиях.
Как показывает опыт, размеры хромосомы на фотографии могут варьировать в зависимости от длительности экспозиции. Как правило, отдельные детали на негативе бывают видны более чётко, чем на соответствующих фотографиях.
Независимо от способа измерений определяются следующие характеристики хромосом:
– относительная длина L – отношение длины хромосомы к общей длине гаплоидного набора (включая Х-хромосому), выраженное в промилле;
– центромерный индекс Iс – отношение короткого плеча к длине всей хромосомы, в процентах.
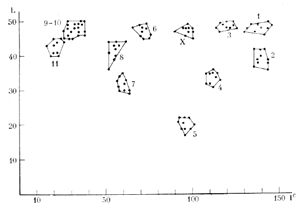
Все метафазные пластинки, использованные для кариограммного анализа, должны быть кариотипированы и пары хромосом представлены на кариотипах в одинаковой последовательности. Если в кариотипе имеются несколько пар морфологически неотличимых хромосом, то их следует поставить группой, не разбивая на пары. По абсолютным значениям индексов L и Iс для наглядности могут быть построены поликариограммы (рис. 5). |
Если исследователь намерен провести сравнительный анализ кариотипов двух близких видов или кариологически отли- |
|
чающихся популяций, то в таком случае можно воспользоваться методом наложения поликариограмм (Павулсоне и др., 1970). Этот метод позволяет выявить гомологичные пары хромосом и опять-таки компетентен лишь в том случае, если сравниваются выборки, степень спирализации хромосом в которых варьирует в достаточно узком диапазоне.
– 31 –
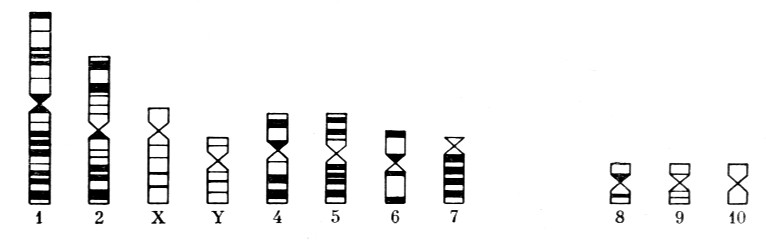
На основании средних значений индексов L и соотношения плеч составляется идиограмма хромосомного набора, схема-тично изображающая гаплоидный кариотип исследуемого вида (рис. 6).
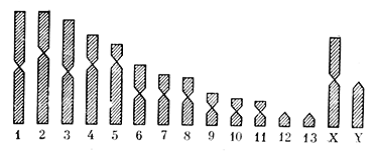
Рис. 6. Идиограмма джунгарского хомячка
После измерений хромосом проводится статистическая обработка материалов, определяются средние значения параметров (М) и ошибка средней (m). Если необходимо определить достоверность полученных различий, то она находится по стандартным значениям критерия Стьюдента (Плохинский, 1970). Цифровые данные могут быть вынесены в таблицы.
Анализ мейотических хромосом
Анализ мейотических хромосомных препаратов намного сложнее, чем митотических. Мы рекомендуем обратиться к специальным работам и ограничимся лишь несколькими замечаниями. Мейотические хромосомы чаще всего исследуют на стадии поздней профазы (диплотена, диакинез) или метафазы I. В поздней профазе хорошо видны биваленты, т. е. попарно конъюгирующие гомологичные хромосомы. На мейотических препаратах удается подсчитать диплоидное число и идентифицировать половые хромосомы (рис. 7).
– 32 –
При описании мейотических хромосом обращают внимание на форму бивалентов, подсчитывают число хиазм в каждом биваленте и среднее число хиазм на клетку, описывают способ конъюгации Х- и Y-хромосом в половом биваленте (с образованием или без образования хиазм между ними) или форму полового тривалента (в случае множественных половых хромосом). – 30
Клетки на стадии диакинеза фотографируются и составляются кариограммы в стадии диакинеза, причём часто каждый бивалент дополнительно схематически зарисовывается.
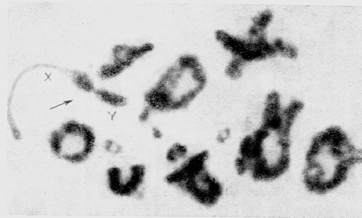
Рис. 7. Диакинез самца джунгарского хомячка. Стрелкой показан половой бивалент.
Х- и Y-хромосомы конъюгируют конец к концу.
Структурные изменения в хромосомном наборе (например, транслокации), не выявляемые при анализе митотических хромосом в соматических клетках, ведут к нарушению конъюгации хромосом в мейозе и к образованию три-, тетра- или унивалентов. Особенно важен анализ мейоза гибридных особей, позволяющий в некоторых случаях выявить причину стерильности или пониженной плодовитости гибридов, обнаружить или подтвердить наличие у них хромосомных перестроек.
ЛИТЕРАТУРА
Гиндилис В. М. 1966. Митотическая сппрализация хромосом и кариограммный анализ у человека.– Цитология, 8, 2, 144–157.
Дыбан А. П. 1970. Метод приготовления препаратов мейотических и митотиче-ских хромосом из семенников млекопитающих.– Цитология, 12, 5, 687–689.
Павулсоне С. А., Иорданский А. В., Гиндилис В. М. 1970. Сравнительный морфо-метрический анализ хромосом Allium сера и Allium fistulorum L.– Генетика, 6, 2, 40–57.
Павулсоне С. А., Иорданский А. В. 1971. Новый способ повышения разрешающей способности кариограммного анализа.– Генетика, 7, 4, 149–153.
Плохинский И. А. 1970. Биометрия. М., Изд-во МГУ.
Прокофъева-Белъговская А. А., Гиндилис В. М. 1965. Идентификация хромосом человека.– Изв. АН СССР, серия биол., 2, 188.
Раджабли С. И., Крюкова Е. П. 1973. Сравнительный анализ дифференциальной окраски хромосом двух видов хомячков: даурского и китайского.– Цитоло-гия, 15, 12, 1527–1531.
Arrighi F. Е., HSU Т. С. 1971. Localization of heterochromatin in human chromo-somes.– Cytogenetics, 10, 81–86.
Caspersson Т., Zech L., Johansson C, Lindsten J., Hulten M. 1970. Fluorescent staining of heteropycnotic chromosome regions in human interphase nuclei. –Exptl. Cell Res., 61, N 2–3, 472 – 474.
Evans E.P., Breckon G., Ford С. Е. 1964. An air-drying method for meiotic prepara-tions from mammalian testes.– Cytogenetics, 3, N 5, 289–294.
Evans H.P., Buckion К. Е., Sumner A. F. 1971. Cytological mapping of human chro-mosomes: results oftained with qwinacrine fluorescence and the acetic saline.– Giemsa techniques. Chromosome, 35, N 3, 310-325.
Ford R., Hamerton J. L. 1956. A colchicine hypotonic citrate squash sequence for mammalian chromosoma.– Stain Technology, 31, N 6, 247–251.
Levan A., Fredga K., Sanderson A. A. 1964. Nomenclature for contro-meric position on chromosmes.– Hereditas, 52, 201–220.
Lin C. C, Uchida J. A., Byrnes E. 1971. A suggestion for the nomenclature of the fluorecent banding patterns in human metaphase chromosomes.– Canad. J. Genet, and Cytol., 13, 361–363.
Makino S., Nishimura J. 1952. A water pretreatment squash technique.– Stain Tech-nology, 27, N 1, 1.
Matthey R. 1949. Les chromosomes des vertebres. Lausanna.
Meredith R. 1969. A simple method for preparing meiotic chromosomes from mam-malian testis.– Chromosoma, 26, N 3, 254–259.
Moorhead P. S., Nowell P. C, Mellman W.J, Battlps D. M., Hunge-jord D. A. 1960. Chromosome preparations of leucocytes cultured from human peripheral blood.– Exptl Cell Res., 20, N 3, 613–616.
Purdue M. L., Gall J. G. 1970. Chromosomal localization of mouse satellite DNA.– Science, 168, 1356.
Rothfels K., Siminovitch L. 1958. Air drying- technique for flattening chromosomes in mammalian cells grown in vitro/– Stain. Technology, 33, 73.
Sachs L. 1953. Simple methods for mammalian chromosomes.– Stain Technology, 28, N 4, 169.
Schnedl W. 1971. Banding pattern of human chromosomes.– Nature New Biol., 233, 93-94.
Seabright M. 1971. A rapid banding technique for human chromosomes.- Lancet, 7731, 971-972.
Zech L. 1969. Investigation of metaphase chromosomes with DNA – banding fluoro-chromes.– Exptl. Cell Res., 58, 463.
.
Ваш комментарий о книге
Обратно в раздел Наука
|
|



