Библиотека
Теология
Конфессии
Иностранные языки
Другие проекты
|
Ваш комментарий о книге
Гусейханов М., Раджабов О. Концепции современного естествознания: Учебник
Глава 9. СОСТАВ, СТРУКТУРА И ВЗАИМОПРЕВРАЩЕНИЯ ВЕЩЕСТВ
Истинный химик должен уметь доказывать познанное... то есть давать ему объяснение...
М. В. Ломоносов
9.1. Концептуальные уровни познании веществ
Закономерности, происходящие в веществах, процессы их превращения, при которых происходит изменение их состава и структуры, изучает раздел естествознания — химия. Она занимается явлениями природы, сопровождающими химические изменения вещества, изучает причины и законы управления химическими процессами, а также рассматривает составные части вещества и их применение на практике. Отдельные химические процессы (получение металлов из руд, крашение тканей и др.) использовались еще на заре становления человеческой цивилизации. Позже, в III—IV вв., зародилась алхимия, задачей которой было превращение неблагородных металлов в благородные (золото, серебро). Начиная с эпохи Возрождения химические исследования все в большей мере стали использовать для практических целей (металлургия, стеклоделие, керамика, получение красок и т. д.).
Химию можно определить как науку, изучающую вещества и процессы их превращения, сопровождающиеся изменением состава и структуры. Химический процесс сопровождается изменением состава веществ, их структуры и обязательно энергетическими изменениями в реагирующей системе. Вследствие взаимосвязанности форм движения материи и их взаимопре-
197
вращаемости в результате химических реакций имеет место превращение химической энергии в теплоту, свет и проч. Химия нужна человечеству для того, чтобы из вещества природы получать по возможности все необходимое — металлы, цемент, бетон, керамику, фарфор, стекло, каучук, пластмассы, искусственные волокна, лекарства и многое другое.
Основой химической науки является атомно-молекулярное учение (АМУ), закон сохранения материи, периодический закон и теория строения вещества, учение о химическом процессе (кинетика). Химические процессы подчиняются всеобщим законам природы — закону сохранения массы вещества и закону сохранения энергии. Закон сохранения массы вещества открыли М. В. Ломоносов и А. Л. Лавуазье почти независимо друг от друга. Они далеко продвинули развитие химии тем, что при химических реакциях применили физические методы, в частности взвешивание. Закон сохранения массы в химических процессах можно сформулировать так: сумма масс исходных веществ (соединений) равна сумме масс продуктов химической реакции. Например, при разложении воды масса воды будет равна сумме массы водорода и массы кислорода. Из закона сохранения вещества вытекает, что вещество нельзя ни создать из ничего, ни уничтожить совсем. Количественным выражением закона сохранения массы веществ применительно к производственному химическому процессу является материальный баланс, в котором подтверждается, что масса веществ, поступивших на технологическую операцию, равна массе полученных веществ. Закон сохранения энергии действует во всех случаях и повсюду, где одна форма энергии переходит в другую.
Несмотря на обилие эмпирического материала о свойствах различных веществ и их соединений, особенностях протекания разнообразных реакций, в химии, до открытия в 1869 г. периодической системы химических элементов Д. И. Менделеева не существовало той объединяющей концепции, с помощью которой можно было бы объяснить весь накопленный фактический материал. Было бы, однако, неправильно не учитывать той громадной исследовательской работы, которая привела к утверждению сис-
198
темного взгляда на химические знания. Развитие теоретических основ химии диктуется потребностью химического производства совершенствовать управление химическим процессом для получения веществ с заранее заданными свойствами.
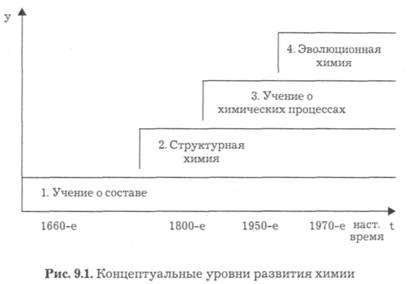
Историю развития теоретических основ химии можно представить в виде следующих этапов.
В период зарождения химии как науки (вторая половина XVII в.) возникло первое концептуальное учение о составе. Объяснение свойств веществ связывалось с их составом, а изменением состава объяснялось химическое превращение. Последующее становление учения (концептуального уровня) о составе определило открытие стехиометрических законов (закона постоянства состава, закона эквивалентов и закона кратных отношений), развитие понятия химического элемента, представлений о валентности, периодическом законе и периодической системе химических элементов Д. И. Менделеева, методах исследования состава соединений и др.
Второй концептуальный уровень развития химии связан с зарождением структурной химии (XIX в.). Было замечено, что огромное разнообразие веществ растительного и животного происхождения образовано весьма небольшим числом химических элементов (углерод, водород, кислород, азот и некоторые др.). К тому же при одинаковом составе вещества (изомеры) имеют разные свойства. Это означало, что свойства веществ зависят не только от состава, но и от структуры (А. М. Бутлеров разработал основные положения). Если при зарождении химии как науки главным направлением был химический анализ, то с появлением структурной химии стал органический синтез. Сегодня структурная химия строится на квантово-механических представлениях о химической связи, строении молекул и кристаллов, на методах исследования структуры веществ, изучении влияния структуры на свойства веществ и проч.
Третий уровень в развитии химии связан с возникновением (конец XIX в.) и развитием учения о химическом процессе — о его принципиальной возможности и условиях протекания. Это было вызвано резким возрастанием потребностей и масштабов
199
производства продуктов химической переработки нефтяного сырья. Учение о химическом процессе рассматривает энергетику химических процессов, химическое равновесие и условия его смещения, кинетику и механизмы реакций и т. д. Этот уровень познания представляет собой исследование внутренних механизмов и условий протекания химических процессов, таких как температура, давление, скорость протекания реакций и некоторые другие.
Наконец, четвертый концептуальный уровень является дальнейшим развитием предыдущего уровня, связанным с более глубоким изучением природы реагентов, участвующих в химических реакциях, а также с применением катализаторов, значительно ускоряющих скорость их протекания. На этом уровне мы встречаемся уже с простейшими явлениями самоорганизации, изучаемыми синергетикой.
В наши дни наблюдается новый уровень развития химии, который направлен на создание наиболее экономичного и экологически чистого безотходного химического производства, использование в промышленных масштабах закономерностей химических превращений живой природы.
Тридцатые годы ознаменовались следующим скачком — появлением теории молекулярных орбиталей (МО). Теория МО позволила успешно описать строение, электронное устройство многих органических соединений. Так, например, были выведены правила, позволяющие предсказать, будет ли еще не синтезированное соединение ароматическим. Концептуальные системы химии изображены на рис. 9.1, в котором вертикальная координата у представляет массив всей теоретической и эмпирической информации, накопленной со времен Бойля и до настоящего времени, а горизонтальная координата t— историческое время.
Как видно, в развитии химии происходит не смена, а строго закономерное последовательное появление концептуальных систем. При этом каждая вновь появляющаяся система не отрицает низлежащую предыдущую, а наоборот, опирается на нее и включает ее в себя в преобразованном виде. Так, например, учение о химических процессах предполагает наличие знаний о составе исходного сырья, о строении молекул исходных реа-
200
гентов и об их реакционной способности, потому что эти знания позволяют химику подобрать исходное сырье для получения целевого продукта. Но этих знаний недостаточно для того, чтобы осуществить химический процесс с максимальным экономическим эффектом и соблюдением экологических требований охраны окружающей среды. Для этого дополнительные знания дает учение о химических процессах — термодинамика, химическая кинетика, химическая технология.
9.2. Состав вещества и химические системы
Во тьме должны обращаться физики, а особливо химики, не зная внутренних, нечувствительных частиц строения.
М. В. Ломоносов
В настоящее время химическим элементом называют вещество, все атомы которого обладают одинаковым зарядом ядра,
201
хотя и различаются по своей массе, вследствие чего атомные веса элементов не выражаются целыми числами.
Молекулой по-прежнему называют наименьшую частицу вещества, которая определяет его свойства и может существовать самостоятельно. Однако к молекулам теперь относят также разнообразные другие квантово-механические системы (ионные, атомные монокристаллы, полимеры и другие макромолекулы). Последнее особенно важно для ясного понимания структуры с точки зрения системного подхода, где под структурой подразумевают упорядоченную связь и взаимодействие между элементами системы, благодаря которой и возникают новые целостные ее свойства. В такой химической системе, как молекула, именно специфический характер взаимодействия составляющих ее атомов определяет свойства молекулы.
Химия изучает процессы превращения молекул при взаимодействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного поля), во время которых образуются новые химические связи. Под химической связью понимается результат взаимодействия между атомами, выражающийся в создании определенной конфигурации атомов, отличающий один тип молекулы от другого. Химические связи порождают взаимодействие электронных оболочек атомов. Если атомные конфигурации подходят друг к другу, возникает одна округлая структура, несколько большая, чем до этого был каждый атом в отдельности. Так получается насыщенная молекула, и присоединить к ней еще какой-то атом почти невозможно, т. е. химические связи отличаются насыщенностью. С введением понятия валентности ею стали объяснять строение и химические свойства молекул. Наиболее распространены четыре вида химических связей: ионная, ковалентная, металлическая и водородная. Химическая связь, осуществляемая за счет образования общих для взаимодействующих атомов электронных пар, называется ковалентной связью. Химическая связь, в основе которой лежит электростатическое взаимодействие ионов, называется ионной. Химическая связь, основанная на обобществлении валентных электронов всех атомов в кристалле, называется
202
металлической. Химическая связь, обусловленная взаимодействием полярных молекул, одной из которых является водород, называется водородной. Химические связи можно рассматривать с точки зрения превращения энергии: если при создании молекулы ее энергия меньше, чем сумма энергий составляющих ее изолированных атомов, то она может существовать, т. е. ее связь устойчива.
Каждое вещество характеризуется определенными физическими и химическими свойствами. Когда какое-нибудь простое вещество вступает в химическую реакцию и образует новое вещество, то оно при этом теряет большинство своих свойств. Например, железо, соединяясь с серой, теряет металлический блеск, ковкость, магнитные свойства и др. Следовательно, в сульфиде железа нет железа, каким мы знаем его в виде простого вещества. Но так как из сульфида железа (FeS) при помощи химических реакций можно снова получить металлическое железо, то говорят что в состав сульфида железа входит элемент железо, понимая под этим тот материал, из которого состоит металлическое железо. Точно так же водород (Н) и кислород (О), входящие в состав воды, содержатся в воде не в виде газообразных водорода и кислорода с их характерными свойствами, а в виде элементов — водорода и кислорода. Если же элементы находятся в "свободном состоянии", т. е. не связаны химически ни с каким другим элементом, то они образуют простые вещества.
Долгое время не делалось различия между элементом и простым веществом. Понятие "элемент" в качестве научного термина впервые использовано Р. Бойлем в 1661 г. Со времен Бойля элементом считали всякое простое вещество, которое можно получить в результате разложения сложных веществ, но которое не способно к дальнейшему разложению на еще более простые вещества.
Также была опровергнута флогистонная теория окисления металла многочисленными экспериментами М. В. Ломоносова. Согласно этой теории процесс окисления металла рассматривался как реакция разложения: металл считался сложным веществом, а окалина простым, т. е. железо —» окалина + флогистон.
203
М. В. Ломоносов, проведя эксперименты в запаянных ретортах, установил, что масса сосуда с прокаленным железом не меняется, если взвесить, не вскрывая его. Французский ученый А. Лавуазье также показал, что горение есть реакция соединения вещества с кислородом воздуха. Лавуазье поставил на ноги всю химию, которая в своей флогистонной форме стояла на голове.
Начало XIX в. ознаменовалось открытием новых количественных закономерностей. Разработка атомно-молекулярной теории позволила Дальтону высказать атомную гипотезу и ввести в химию понятие об относительном атомном весе элементов и определить атомные веса некоторых элементов. По Дальтону, элемент можно определить как вид атомов, характеризующихся определенным значением атомного веса, а простые вещества состоят из определенного вида атомов, следовательно, простые вещества суть элементы. Путаница была устранена позже, когда было установлено, что многие простые вещества образованы из молекул, а не из атомов. Впервые Менделеев в связи с этим указал на необходимость ясно различать два понятия: элемент и простое вещество, или простое тело. Если простому веществу (телу) соответствует понятие о частице, то элементу — об атоме. Углерод есть элемент, а уголь, графит и алмаз суть тела простые.
Пользуясь понятием о химических элементах, можно сказать, что важнейшая задача химии состоит в изучении свойств элементов в отыскании общих закономерностей в их поведении и в отношении между собой. К середине XIX в. насчитывалось уже 63 элемента и был накоплен достаточно богатый экспериментальный материал, касающийся их физических и химических свойств, и были установлены групповые общие свойства. Были накоплены сведения и о таких характеристиках, как атомная масса элементов и их валентность, т. е. способность образовывать различные формы соединений. Прежде всего нужно было решить основной вопрос: являются ли химические элементы разрозненными, независимыми или они закономерно связаны между собой в единую систему.
204
Первые попытки решения этой задачи относятся к первой половине XIX в. Деберейнер (1829 г.) сгруппировал элементы в триады; Одлинг (1857 г.) разместил 48 элементов в единую таблицу из 13 групп сходственных элементов; Ньюлендс и де Шаркунтуа (1863 г.) распределили 63 элемента в порядке возрастания их атомной массы, была опубликована немецким химиком Л. Мейером таблица элементов, в которой отсутствовали бор, алюминий и водород. Всего попыток классификации было не менее пятидесяти, и все были по существу безуспешны. В основе неудач лежал метафизический способ их мышления. Наконец в 1869 г. Д. И. Менделеев предложил периодическую систематизацию свойств элементов.
Диалектико-материалистический подход к систематизации элементов является основной причиной успеха Д. И. Менделеева. Периодическая система элементов оказала большое влияние на последующее развитие химии, она явилась могучим орудием для дальнейших исследований. На основании периодического закона Д. И. Менделеев предсказал существование 12 новых элементов, причем для трех из них (галий — Ga, германий — Ge и скандий — Sc) описал подробно их свойства. В течение полувека были обнаружены в природе почти все элементы, расположенные до урана. Путеводной нитью для поиска и установления химической природы элементов явился периодический закон и метод предсказания, использованный Д. И. Менделеевым. Периодический закон и периодическая система получили свое полное подтверждение и дальнейшее развитие при установлении строения атомов элементов. Сейчас фактические данные в химии выросли в тысячи раз. Имеются сведения о 8 миллионах индивидуальных химических соединений постоянного состава и миллиардах соединений переменного состава.
Современная формулировка периодического закона следующая: от величины положительного заряда ядра атома зависят все свойства элемента и его положение в периодической системе. Теория строения атома объясняет периодическое изменение свойств элементов при переходе от одного периода к другому: с ростом Z строение электронных оболочек атомов повторяется.
205
Особенно это касается внешних энергетических уровней, на которых расположены валентные электроны. В пределах одного периода с увеличением заряда ядра наружные слои заполняются постепенно, достигая своей завершенности в атомах благородных газов. Эта последовательность повторяется в каждом периоде, вследствие чего в них наблюдается переход от металлов в начале периода к неметаллам и благородному газу в его конце. В свете теории строения атома периодический закон получил современную формулировку: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома.
Атомный вес элемента определяется как среднее арифметическое величин масс изотопов, из которых состоит элемент. Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов, называют изотопами. Например, хлор состоит из двух изотопов с массовыми числами на 75,53% из изотопа 35Сl и на 24,47% — из 37Сl, в результате средняя атомная масса хлора равна 35,453. Открытие изотопов потребовало пересмотра понятия "химический элемент". Химический элемент — это вид атомов, характеризующийся определенной величиной положительного заряда ядра. Существование химического элемента в виде нескольких простых веществ называется аллотропией. Графит, алмаз, уголь — аллотропные видоизменения элемента углерода.
С развитием количественных методов исследования в химии были накоплены экспериментальные факты, обобщение которых привело к открытию так называемых стехиометрических законов — закона постоянства состава, закона эквивалентов и закона кратных отношений. Именно эти законы способствовали окончательному утверждению в химии атомно-молекулярного учения. Основой химической науки являются атомно-молекулярное учение, закон сохранения материи, периодический закон Д. И. Менделеева и теория химического строения.
Основные положения атомно-молекулярного учения заключаются в следующем:
206
- Вещества состоят из молекул; молекулы различных веществ отличаются между собой химическим составом, размерами, физическими и химическими свойствами.
- Молекулы находятся в непрерывном движении; между ними существует взаимное притяжение и отталкивание. Скорость движения молекул зависит от агрегатного состояния веществ.
- При физических явлениях состав молекул остается неизменным, при химических — они претерпевают качественные и количественные изменения и из одних молекул образуются другие.
- Молекулы состоят из атомов. Атомы характеризуются определенными размерами и массой. Свойства атомов одного и того же элемента одинаковы и отличаются от свойств атомов других элементов.
Масса атома, выраженная в атомных единицах массы (а.е.м.), называется относительной атомной массой. 1 а.е.м. = = 1,667 10-27кг.
Элементы, соединяясь в разных количественных соотношениях друг с другом, образуют химические соединения — сложные вещества. Что собой представляет химическое соединение? Обладает ли сложное вещество переменным или постоянным составом?
Известный французский химик Ж. Пруст в отличие от К. Бертолле считал, что любое химически чистое соединение независимо от способа его получения имеет вполне определенный состав. Именно на этом законе, получившем название закона постоянства состава, Ж. Пруст объяснил различие между химическими соединениями и смесями. Например СO2 (углекислый газ) можно получить несколькими способами:
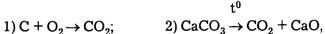
но в чистом СO2 всегда содержится 27,29% С и 72,71% O2 по массе.
Многие элементы, соединяясь друг с другом, могут образовывать разные вещества, каждое из которых характеризуется
207
определенным соотношением между массами этих элементов. Так, углерод и кислород образуют оксид углерода — СО и С02—диоксид углерода. Изучая подобные соединения, английский ученый Д. Дальтон, установил закон кратных отношений: если два элемента образуют друг с другом несколько соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие числа.
Дальтон придерживался атомной теории строения вещества; изучая свойства газов, открыл закон парциальных давлений газов. Закон непосредственно свидетельствовал о том, что элементы входят в состав соединений лишь определенными порциями, что свидетельствует о прерывном строении вещества. Развивая атомно-молекулярную теорию, Дальтон ввел близкое к современному представление об атомах и об относительных атомных массах элементов. Но в отличие от закона сохранения массы, справедливость которого полностью подтверждена открытиями, сделанными после его установления, законы постоянства состава и кратных отношений оказались не столь всеобщими. В связи с открытием изотопов выяснилось, что соотношение между массами элементов, входящих в состав данного вещества, постоянно лишь при условии постоянства изотопного состава этих элементов. Например, тяжелая вода содержит 20% (масс) водорода, а обычная вода лишь 11%.
В начале XX в. (более чем через 100 лет) русский ученый Н. С. Курнаков, изучая сплавы металлов, открыл соединения переменного состава, в которых на единицу массы данного элемента может приходиться различная масса другого элемента. Для многих соединений переменного состава установлены пределы, в которых может изменяться их состав, и формула TiO2 более точно выражает свой состав в виде TiO1.9_2.0. Конечно, такого рода формулы указывают не состав молекулы (вещества имеют атомную структуру), а лишь отражают границы состава вещества. Периодическая система представляет пример упорядоченного конечного счетного множества химических элементов. А можно ли подобным образом упорядочить множество химических соединений, число которых хоть и велико, но не безгранично? И вот
208
оказалось, что вещества с одинаковыми суммами атомных номеров, молекулярных масс и плотностями обладают чрезвычайно близкими физико-химическими свойствами. Достаточно знать химический состав вещества и его плотность, чтобы предсказать и все его прочие свойства. Н. С. Курнаков предложил назвать соединения бертоллоидами в честь К. Бертолле, который впервые предсказал существование веществ переменного состава.
Таким образом, существует обширный класс соединений, не подчиняющихся стехиометрическим соединениям, законам, т. е. нарушение законов связано с вполне определенным агрегатным состоянием вещества.
В принципе, нет четкой границы между соединениями постоянного и переменного состава с точки зрения современной физики. Соединение может быть образовано и из атомов одного химического элемента — простое вещество. Сложное вещество образовано из атомов различной природы, т. е. в состав молекулы сложных веществ входят различные элементы. Вода образована атомами водорода и кислорода, а вещество кислород только из молекул одного элемента — кислорода. Но один элемент кислород образует два аллотропных видоизменения простых веществ кислород и озон, которые отличаются строением, структурой, физическими и химическими свойствами.
9.3. Структура вещества и его свойства
Надо было исследовать предметы, прежде чем можно было приступить к исследованию процессов. Надо сначала знать, что такое данный предмет, чтобы можно было заняться теми изменениями, которые с ним происходят.
Ф. Энгельс
Характер любого химического соединения зависит не только от качественного и количественного состава, но и от взаимного
209
влияния атомов и строения молекулы — мельчайшей химической системы.
Вещества, имеющие одинаковую молекулярную формулу, называют изомерами, а само явление — изомерией. Формулу С4Н8O имеет 21 вещество. Долгое время вплоть до XVIII в. химики не делали различия и между минеральными и органическими веществами. Именно явление изомерии заставляет, не довольствуясь установлением молекулярной формулы, идти дальше, выясняя детали внутреннего строения молекул органических веществ, структуру соединения. Структуру молекул органических соединений пытался объяснить шведский химик Й. Берцелиус в своей теории радикалов. В ней он наивно полагает, что структура молекул зависит от электрических зарядов в молекулах органических соединений.
На смену теории радикалов пришла теория типов французского ученого Ш. Жерара, которая рассматривала органические соединения как производные простейших веществ: водорода, воды, аммиака. Формулы получались сходные с современными, но в них вкладывалось содержание совершенно иное: формулы теории типов — это только формулы превращения. Внутреннее строение молекул считали непознаваемым, становясь на позицию агностицизма — философского учения, ставящего границы человеческому познанию. "Анархия" в химии пошла на убыль благодаря работам Э. Франкланда и Ф. Кекуля. В химии утвердилось понятие о валентности, в частности развилось представление о четырехвалентности углерода. Благодаря трудам С. Канниццаро была внесена ясность в вопрос об атомных и молекулярных массах, об эквивалентах.
Таким образом, к 1860 г. было достигнуто понимание фундаментальных понятий химии (атом, молекула, эквивалент, валентность), признана справедливость закона Авогадро. Все это способствовало развитию химии в области получения веществ с заранее заданными специфическими свойствами, что являлось крупным шагом вперед. Дальнейшее развитие теория строения находит в трудах русского ученого А. М. Бутлерова. Атомы в органических молекулах связаны друг с другом в определенном
210
порядке химическими силами (силами валентности). Теория Бутлерова потому и названа теорией химического строения, что она указывала не на пространственное сорасположение атомов в молекуле, а на распределение действия химических сил сродства. Она указывала на причины активности одних веществ и пассивности других. Более того, она указывала на наличие активных центров и активных группировок в структуре молекулы. И именно поэтому она стала для химиков действенным руководством в практике синтеза органических веществ. Идеи об энергетической неэквивалентности химических связей, обусловленной взаимным влиянием атомов в структуре молекулы, являются главным содержанием понятия "структура" в теории Бутлерова.
Теория химического строения Бутлерова нашла физические обоснования в квантовой механике. Сегодня под структурой молекул мы понимаем и пространственную, и энергетическую упорядоченность квантово-механической системы, состоящей из атомных ядер и электронов и обладающей единой молекулярной орбиталью. Вообще же понятию "структура" в химии можно дать единое определение: структура — это устойчивая упорядоченность качественно неизменной системы, каковой является молекула. Воззрения Кекуле и Бутлерова превратили химию из науки аналитической, занимающейся изучением состава готовых веществ, в науку преимущественно синтетическую, способную создавать новые вещества и новые материалы. Пространственная структура расположения атомов в молекуле, особенно в органической химии, определяет свойства веществ и особенности химических реакций.
Структуру устанавливают физическими методами — ядерный магнитный резонанс, электронография, масс-спектрометрия и др. Формулы строения выражают порядок химической связи атомов и каждое вещество имеет одну определенную формулу строения, отражающую порядок химической связи атомов в реально существующей молекуле. Физические и химические свойства органических соединений определяются составом и строением их молекул. В то же время можно было судить лишь
211
о химическом строении — порядке химической связи атомов. В настоящее время имеется возможность определять пространственное строение: определять распределение электрических зарядов — электронное строение. Все три особенности строения составляют одно качественное целостное строение органического соединения. Например, формула С2НбО отвечает двум различным веществам: диметиловый эфир СН3ОСН3, этиловый спирт С2Н5ОН. Благодаря успехам химии и физики, в настоящее время знают, что химические явления связаны с процессами, происходящими в электронной оболочке атомов.
В определении строения молекулы как единой целостной системы все больше стали применять различные физико-химические методы, основанные на законах квантовой механики. К таковым относятся: рефрактометрия, спектроскопия, спектральный ядерный магнитный резонанс (ЯМР), электронный парамагнитный резонанс (ЭПР). В настоящее время разработаны методы исследования структуры и свойств химических волокон и пленок акустическим методом.
Многочисленные опыты проводятся в области зависимости структуры вещества от его биологической активности. В связи с этим заслуживает внимания новый метод количественных соотношений структура—активность (сокращенно — КССА), уже зарекомендовавший себя в фармакологии, но пригодный для поиска любых веществ с заранее заданными свойствами.
Таким образом, эволюция понятия химической структуры осуществлялась в направлении, с одной стороны, анализа ее составных частей или элементов, а с другой — установления характера физико-химического взаимодействия между ними. Последнее особенно важно для ясного понимания структуры с точки зрения системного подхода, где под структурой подразумевают упорядоченную связь и взаимодействие между элементами системы, благодаря которой и возникают новые целостные ее свойства. В такой химической системе, как молекула, именно специфический характер взаимодействия составляющих ее атомов определяет свойства молекулы.
212
9.4. Химические процессы
О значительнейших вещах не будем судить слишком быстро.
Гераклит
Химический процесс (от лат. processus— продвижение) представляет собой последовательную смену состояний вещества, тесную связь следующих друг за другом стадий развития, представляющую непрерывное, единое движение. Учение о химических процессах — это область науки, в которой существует наиболее глубокое взаимопроникновение физики, химии и биологии. Химические процессы подразделяются на: гомо- и гетерогенные (в зависимости от агрегатного состояния реагирующих систем), экзо- и эндотермические (в зависимости от количества выделяющейся и поглощаемой теплоты), окислительные, восстановительные (в зависимости от отношения к кислороду) и др.
Все процессы, которые протекают вокруг нас, можно объединить в три большие группы.
1. Самопроизвольные процессы, которые можно использо
вать для получения энергии или совершения работы. Условиями
протекания самопроизвольных процессов или законами термо
динамики, характеризуемыми их, являются: а) в изолированной
системе, т. е. в системе, для которой исключен любой материаль
ный или энергетический обмен с окружающей средой, сумма
всех видов энергии есть величина постоянная; б) изменение
энтальпии (тепловой эффект процесса, АН) зависит только от
вида и состояния исходных веществ и продуктов и не зависит
от пути перехода. Он носит название закона Гесса и сформули
рован им в 1840 г.
2. Процессы, для осуществления которых требуется затрата
энергии или совершение работы.
3. Самоорганизация химической системы, т. е. самопроиз
вольный процесс, проходящий без изменения энергетического
запаса системы, совершается только в направлении, при котором
213
порядок в системе увеличивается, т. е. где энтропия уменьшается.
Способность к взаимодействию различных химических реагентов определяется не только их атомно-молекулярной структурой, но и условиями протекания химических реакций. Процесс превращения одних веществ в другие называется химической реакцией. К условиям протекания химических процессов относятся прежде всего термодинамические факторы, характеризующие зависимость реакций от температуры, давления и некоторых других условий. На скорость химической реакции также влияют следующие условия и параметры:
- природа реагирующих веществ (например, щелочные металлы растворяются в воде с образованием щелочей и выделением водорода и реакция протекает при обычных условиях моментально, а цинк, железо и другие реагируют медленно и с образованием оксидов, а благородные металлы не реагируют вообще);
- температура. При повышении температуры на каждые 10 °С скорость реакции увеличивается в 2-4 раза (правило Вант-Гоффа). Со многими веществами кислород начинает реагировать с заметной скоростью уже при обыкновенной температуре (медленное окисление). При повышении температуры начинается бурная реакция (горение);
- концентрация. Для веществ в растворенном состоянии и газов скорость химических реакций зависит от концентрации реагирующих веществ. Горение веществ в чистом кислороде происходит интенсивнее, чем в воздухе, где концентрация кислорода почти в 5 раз меньше. Здесь справедлив закон действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ;
- площадь поверхности реагирования. Для веществ в твердом состоянии скорость прямо пропорциональна поверхности реагирующих веществ. Железо и сера в твердом состоянии реагируют достаточно быстро лишь при предварительном измельчении и перемешивании: горение хвороста и полена;
214
5) катализатор. Скорость реакции зависит от катализаторов, веществ которые ускоряют химические реакции, но сами при этом не расходуются. Разложение бертолетовой соли и пероксида водорода ускоряется в присутствии оксида марганца (IV) и др.
Для вступления в химическую реакцию необходимо преодолеть некоторый энергетический барьер, соответствующий энергии активации, возможность накопления которой сильно зависит от температуры. Многие реакции долгое время не могут закончиться. В таком случае говорят, что реакция достигла химического равновесия. Химическая система находится в состоянии равновесия, если выполняются следующие три условия:
- в системе не происходит энергетических изменений (
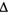 Н = 0); Н = 0);
- не происходит изменений степени беспорядка (,
 S = 0); S = 0);
- не изменяется изобарный потенциал (
 J = 0). J = 0).
Вант-Тофф, используя термодинамический подход, классифицировал химические реакции, а также сформулировал основные положения химической кинетики. Химическая кинетика изучает скорости протекания химических реакций. Ле Шателье сформулировал закон смещения химического равновесия в химических реакциях под влиянием внешних факторов — температуры, давления и др. Согласно принципу Ле Шателье, если на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие (изменяется температура, давление или концентрация), то положение равновесия химической реакции смещается в ту сторону, которая ослабляет данное воздействие.
Химические реакции классифицируют по изменению качества исходных веществ и продуктов реакции на следующие виды:
реакции соединения — реакции, при которых из нескольких веществ образуется одно вещество, более сложное, чем исходные;
реакции разложения — реакции, при которых из одного сложного вещества образуется несколько веществ;
реакции замещения — реакции, при которых атомы одного элемента замещают атом другого элемента в сложном веществе и при этом образуются два новых — простое и сложное;
реакции обмена — реакции, при которых реагирующие вещества обмениваются своими составными частями, в результате
215
чего из двух сложных веществ образуются два новых сложных вещества.
По тепловому эффекту химические реакции можно подразделить на экзотермические — с выделением теплоты и эндотермические — с поглощением теплоты. С учетом явления катализа реакции могут быть каталитические — с применением катализаторов и некаталитические — без применения катализаторов. По признаку обратимости реакции делят на обратимые и необратимые.
В. Оствальд, исследуя условия химического равновесия, пришел к открытию явления катализа. Оказалось, что в большой степени характер и особенно скорость реакций зависят от кинетических условий, которые определяются наличием катализаторов и других добавок к реагентам, а также влиянием растворителей, стенок реактора и иных условий. Явление катализа — селективного ускорения химических процессов в присутствии веществ (катализаторов), которые принимают участие в промежуточных процессах, но регенерируются в конце реакции, широко используется в промышленности, например фиксация азота и водорода, контактный способ производства серной кислоты и многие другие. Впервые синтез аммиака был осуществлен в 1918 г. на основе работ Габера, К. Боша и А. Митташа с помощью катализатора, представляющего собой металлическое железо с добавками окисей калия и алюминия, при температуре 450-550 °Си давлении 300-1000 атмосфер. В настоящее время большое внимание уделяют применению металлоорганических и металлокомплексных катализаторов, отличающихся высокими селективностью и избирательностью действия. Тот же самый процесс синтеза аммиака при использовании металлоорганического катализатора удалось осуществить при обычной температуре (18 °С) и нормальном атмосферном давлении, что открывает большие перспективы в производстве минеральных азотных удобрений. Особенно велика роль катализа в органическом синтезе. Крупнейшим успехом в этом направлении надо признать получение искусственного синтетического каучука из этилового спирта, осуществленное советским академиком С. В. Лебедевым в 20-х годах XX века.
216
Ферменты, или биокатализаторы, играют исключительную роль в биологических процессах и технологии веществ растительного и животного происхождения, а также в медицине. В настоящее время известно свыше 750 ферментов, и их число ежегодно увеличивается. Ферменты являются бифункциональными и полифункциональными катализаторами, так как здесь имеет место согласованное воздействие двух или нескольких групп катализаторов различной природы в составе активного центра фермента на поляризацию определенных связей субстрата. Эта же концепция лежит в основе каталитического действия фермента и теории кинетики действия ферментов. Главное отличие ферментов от других катализаторов заключается в исключительно высокой активности и ярко выраженной специфичности.
Самоорганизация химических систем в биологические, их единство и взаимосвязь подтверждает синтез органических соединений из неорганических. В 1824 г. немецкий химик Ф. Велер, ученик Берцелиуса, впервые получил из неорганического дициана N-C-C-N при нагревании его с водой щавелевую кислоту НООС-СООН — органическое соединение. Также было получено новое органическое вещество — мочевина (карбамид) из цианистого аммония. В 1854 г. во Франции М. Бертло синтетическим путем получил жир. Наибольшим успехом химии 50-60-х гг. XX в. явился первый синтез простых белков — гормона инсулина и фермента рибонуклерозы.
9.5. Эволюция химических систем и перспективы химии
Все наши значим — прошлые, настоящие и будущие — ничто по сравнению с тем, что мы никогда не узнаем.
К. Э. Циолковский
Под эволюцией химической системы понимают самопроизвольный синтез новых химических соединений, являющихся более сложными и более высокоорганизованными продуктами по
217
сравнению с исходными веществами. Химики сегодня пришли к выводу, что, используя те же принципы, на которых построена химия организмов, в будущем можно будет построить принципиально новую химию, новое управление химическими процессами, где начнут применять принципы синтеза себе подобных молекул. По принципу ферментов будут созданы катализаторы такой степени специфичности, что далеко превзойдут существующие в нашей промышленности. Хотя химия в настоящее время еще далека от решения этих проблем, но намечены следующие пути решения этой задачи:
- Развитие исследований в области металлокомплексного катализа с постоянной ориентацией на соответствующие объекты живой природы. Сегодня металлокомплексный катализ постепенно обогащается такими приемами, которыми пользуются живые организмы в ферментативных реакциях, а также приемами классического гетерогенного катализа.
- Освоение каталитического опыта живой природы, заключающегося в определенных успехах моделирования биокатализаторов. Для решения проблемы освоения каталитического опыта живой природы необходимо изучение законов химической эволюции и происхождения жизни.
- Использование достижений иммобилизованных систем. Сущность иммобилизации состоит в закреплении выделенных из живого организма ферментов на твердой поверхности путем адсорбции, которая превращает последние в гетерогенный катализатор и обеспечивает его стабильность и непрерывное действие, т. е. осуществляется биоорганический катализ.
- Развитие исследований, ориентированных на применение принципов биокатализа в химии и химической технологии. Характеризуется изучением и освоением всего каталитического опыта живой природы, в том числе и опыта формирования самого фермента, клетки и даже организма, т. е. это пролог к принципиально новой химической технологии, способной стать аналогом живых систем.
Успехи химии экстремальных состояний, каталитической химии, в областях металлокомплексного катализа, модели-
218
рования биокатализаторов, химии и технологии иммобили-зированных систем, "нестационарной технологии", важным звеном которой должна стать теория саморазвития открытых каталитических систем, позволяют видеть в ближайшей перспективе богатейшие возможности развития новой химии. Эта новая химия уже теперь становится способной решать такие задачи, для реализации которых до сих пор еще не было предпосылок.
В частности, в области тяжелого органического синтеза это задачи: а) значительного ускорения химических превращений в мягких условиях за счет объединения в катализаторах будущего достоинств гетерогенного, гомогенного и металлоэнзимного катализа; б) достижение близкой к 100% селективности процессов;
в) осуществление новых важных энергетически затрудненных
процессов за счет сопряжения эндо- и экзотермических реакций;
г) существенной экономии углеводородного сырья и перехода от
нефти к углю как более распространенному сырьевому источни
ку. Химия теперь имеет реальные предпосылки и для решения
таких общих задач, как: а) моделирование и интенсификация
фотосинтеза; б) фотолиз воды с получением водорода как са
мого высокоэффективного топлива; в) промышленный синтез
широкого спектра органических продуктов, и в первую очередь
метанола, этанола, формальдегида и муравьиной кислоты, на
основе углекислого газа; г) промышленный синтез многочислен
ных фторматериалов.
Все это является залогом успешного претворения в жизнь задач по созданию малоотходных, безотходных и энергосберегающих промышленных процессов, рачительного использования каждого килограмма сырья и каждого киловатта энергии для производства необходимых материалов.
ВЫВОДЫ
1. Состав, структуру вещества и закономерности их взаимопревращений изучают в химии, которая является одним из разделов естествознания.
219
2. Основой химической науки является атомно-молекулярное
учение, закон сохранения материи, периодический закон, теория
строения вещества, учение о химическом процессе.
- Вещество состоит из молекул, а молекулы из атомов. Атомы в молекулах удерживаются химическими связями. Химические связи отличаются насыщаемостью. Валентность атомов определяет характер строения и химические свойства молекул.
- Структура вещества, под которой понимают упорядоченную связь и взаимодействие между элементами системы, определяет целостные ее свойства.
- Для вступления в химическую реакцию необходимо преодолеть некоторый энергетический барьер, соответствующий энергии активации, возможность накопления которой сильно зависит от температуры. К условиям протекания химических процессов относятся прежде всего термодинамические факторы, характеризующие зависимость реакций от температуры, давления и некоторых других условий. В еще большей степени характер и особенно скорость реакций зависят от кинетических условий, которые определяются наличием катализаторов и других добавок к реагентам, а также влиянием растворителей, стенок реактора и иных условий.
- Актуальными проблемами современной химии являются вопросы самоорганизации и эволюции химических систем, использование катализа и биокатализа.
Вопросы для контроля знаний
- Назовите основные этапы эволюции химических систем.
- Назовите основные перспективные направления развития современной химии.
- Чем определяются химические свойства вещества?
- Как объяснялись свойства в процессе эволюции химических знаний?
- Кто впервые указал на зависимость свойств вещества от их состава?
- В чем сущность теории Бутлерова?
220
- От каких факторов зависит активность химических процессов?
- Назовите основные направления в развитии учения о составе вещества.
- Как называются химические соединения постоянного состава?
- Какое общее название носят химические соединения переменного состава?
- Чем обусловливаются химическая связь и свойства атомов?
- Какая связь существует между атомным весом и зарядом ядра атома?
- Перечислите основные уровни химических структур.
- От чего зависит динамика химических процессов?
- Какие вещества называют катализаторами?
- Какую роль играет катализ в эволюции химических систем?
17. Какие функции выполняют ферменты?
.
Ваш комментарий о книге
Обратно в раздел Наука
|
|
