Библиотека
Теология
Конфессии
Иностранные языки
Другие проекты
|
Ваш комментарий о книге
Грушевицкая Т., Садохин А. Концепции современного естествознания
ТЕМА 18 СОВРЕМЕННЫЕ КОНЦЕПЦИИ ХИМИИ
СТРУКТУРА ХИМИИ
До конца XIX века химия в основном была единой целостной наукой. Внутреннее ее деление на органическую и неорганическую не нарушало этого единства. Но последовавшие вскоре многочисленные открытия как в самой химии, так и в биологии, физике положили начало быстрой ее дифференциации.
Современная химическая наука, опираясь на прочные теоретические основы, непрерывно развивается вширь и вглубь. В частности, происходит открытие и изучение новых, качественно различных дискретных химических частиц. Так, еще в первой половине XIX века при изучении электролиза были обнаружены ионы - особые частицы, образованные из атомов и молекул, но электрически заряженные. Ионы являются структурными единицами многих кристаллов, кристаллических решеток металлов, они существуют в атмосфере, в растворах и т.д.
В начале XX века химики открыли радикалы как одну из активных форм химического вещества. Они образуются из молекул путем отщепления отдельных атомов или групп и содержат атомы элементов в необычном для них валентном состоянии, что связано с наличием одиночных (неспаренных) электронов, объясняющих их исключительную химическую активность.
К особым формам химического вещества относятся также макромолекулы. Они состоят из сотен и тысяч атомов и вследствие этого приобретают в отличие от обычной молекулы качественно новые свойства.
Характерный для новейшей химии, как и для всей науки XX века, процесс глубокой внутренней дифференциации в значительной степени связан с открытием этого качественного многообразия химических веществ. Их строение, превращения и свойства стали предметом изучения специальных разделов химии: электрохимии, химической кинетики, химии полимеров, химии комплексных соединений, коллоидной химии, химии высокомолекулярных соединений.
Уже к началу XX века внутри самой химии четко различаются общая и неорганическая химия и органическая химия. Предметом изучения общей и тесно связанной с ней неорганической химии стали химические элементы, образуемые ими простейшие неорганические соединения и их общие законы (прежде всего периодический закон Д.И. Менделеева).
Сильный толчок развитию неорганической химии дали проникновение в недра атома и изучение ядерных процессов. Поиски элементов, наиболее пригодных для расщепления в ядерных реакторах, способствовали исследованию малоизученных и синтезу новых элементов с помощью ядерных реакций. Изучением их свойств, а также физико-химических основ и химических свойств радиоактивных изотопов, методикой их выделения и концентрации занялась радиохимия, возникшая во второй четверти XX века.
Органическая химия окончательно сложилась в самостоятельную науку во второй половине XIX века. Этому способствовало получение большого эмпирического и теоретического материала о соединениях углерода и его производных. Определяющим фактором для всех органических соединений являются особенности валентного состояния углерода - способность его атомов связываться между собой как одинарной, так и двойной, тройной связью в длинные линейные и разветвленные цепи. Благодаря бесконечному многообразию форм сцепления углеродных атомов, наличию изомерии и гомологических рядов почти во всех классах органических соединений возможности получения этих соединений практически безграничны.
В XX веке многие разделы органической химии стали постепенно превращаться в большие, относительно самостоятельные ветви со своими объектами изучения. Так появились:
химия элементоорганических соединений, химия полимеров, химия высокомолекулярных соединений, химия антибиотиков, красителей, душистых соединений, фармакохимия и т.д.
В конце прошлого века возникает химия металлоорганических соединений, то есть соединений, содержащих одну (или более) прямую связь металла с углеродом. До конца века были открыты органические соединения ртути, кадмия, цинка, свинца и др. В настоящее время получены углеродистые соединения с большей частью не только металлов, но и неметаллов (фосфор, бор, кремний, мышьяк и т.д.). Теперь эту область химии стали называть химией элементоорганических соединений, она находится на стыке органической и неорганической химии.
Самостоятельной областью химии является наука о методах определения состава вещества ~ аналитическая химия. Ее основная задача - определение химических элементов или их соединений, входящих в состав исследуемого вещества, - решается путем анализа. Без современных методов анализа был бы невозможен синтез новых химических соединений, постоянный эффективный контроль за ходом технологического процесса и качеством получаемых продуктов.
ВЗАИМОСВЯЗЬ ХИМИИ С ФИЗИКОЙ
Помимо процессов дифференциации самой химической науки, в настоящее время идут и интеграционные процессы химии с другими отраслями естествознания. Особенно интенсивно развиваются взаимосвязи между физикой и химией. Этот процесс сопровождается возникновением все новых и новых смежных физико-химических отраслей знания.
История взаимодействия химии и физики полна примеров обмена идеями, объектами и методами исследования. На разных этапах своего развития физика снабжала химию понятиями и теоретическими концепциями, оказавшими сильное воздействие на развитие химии. При этом чем больше усложнялись химические исследования, тем больше аппаратура и методы расчетов физики проникали в химию. Необходимость измерения тепловых эффектов реакции, развитие спектрального и рентгеноструктурного анализа, изучение изотопов и радиоактивных химических элементов, кристаллических решеток вещества, молекулярных структур потребовали создания и привели к использованию сложнейших физических приборов -спектроскопов, масс-спектрографов, дифракционных решеток, электронных микроскопов и т.д.
Развитие современной науки подтвердило глубокую связь между физикой и химией. Связь эта носит генетический характер, то есть образование атомов химических элементов, соединение их в молекулы вещества произошло на определенном этапе развития неорганического мира. Также эта связь основывается на общности строения конкретных видов материи, в том числе и молекул веществ, состоящих в конечном итоге из одних и тех же химических элементов, атомов и элементарных частиц. Возникновение химической формулы движения в природе вызвало дальнейшее развитие представлений об электромагнитном взаимодействии, изучаемом физикой. На основе периодического закона ныне осуществляется прогресс не только в химии, но и в ядерной физике, на границе которой возникли такие смешанные физико-химические теории, как химия изотопов, радиационная химия.
Физика и химия изучают практически одни и те же объекты, но только каждая из них видит в этих объектах свою сторону, свой предмет изучения. Так, молекула является предметом изучения не только химии, но и молекулярной физики. Если первая изучает ее с точки зрения закономерностей образования, состава, химических свойств, связей, условий ее диссоциации на составляющие атомы, то последняя статистически изучает поведение масс молекул, обусловливающее тепловые явления, различные агрегатные состояния, переходы из газообразной в жидкую и твердую фазы и обратно, - явления, не связанные с изменением состава молекул и их внутреннего химического строения. Сопровождение каждой химической реакции механическим перемещением масс молекул реагентов, выделение или поглощение тепла за счет разрыва или образования связей в новых молекулах убедительно свидетельствуют о тесной связи химических и физических явлений. Так, энергетика химических процессов тесно связана с законами термодинамики, изложенными выше. Химические реакции, протекающие с выделением энергии - обычно в виде тепла и света, называются экзотермическими. Существуют также эндотермические реакции, протекающие с поглощением энергии. Все сказанное не противоречит законам термодинамики: в случае горения энергия высвобождается одновременно с уменьшением внутренней энергии системы. В эндотермических реакциях идет повышение внутренней энергии системы за счет притока тепла. Измеряя количество энергии, выделяющейся при реакции (тепловой эффект химической реакции), можно судить об изменении внутренней энергии системы. Он измеряется в килоджоулях на моль (кДж/моль).
Частным случаем первого начала термодинамики является закон Гесса. Он гласит, что тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса. Закон Гесса позволяет вычислить тепловой эффект реакции в тех случаях, когда его непосредственное измерение почему-либо неосуществимо.
С возникновением теории относительности, квантовой механики и учения об элементарных частицах раскрылись еще более глубокие связи между физикой и химией. Оказалось, что ключ к объяснению существа свойств химических соединений, самого механизма превращения веществ лежит в строении атомов, в квантово-механических процессах его элементарных частиц и особенно электронов внешней оболочки. Именно новейшая физика блестяще решила такие вопросы химии, как природа химической связи, особенности химического строения молекул органических и неорганических соединений и т.д.
В области соприкосновения физики и химии возник и успешно развивается сравнительно молодой из основных разделов химии - физическая химия, которая оформилась в конце XIX века в результате успешных попыток количественного изучения физических свойств химических веществ и смесей, теоретического объяснения молекулярных структур. Экспериментальной и теоретической базой для этого послужили работы Д.И. Менделеева (открытие периодического закона), Вант-Гоффа (термодинамика химических процессов), С. Аррениуса (теория электролитической диссоциации) и т.д. Предметом ее изучения стали общетеоретические вопросы, касающиеся строения и свойств молекул химических соединений, процессов превращения веществ в связи с взаимной обусловленностью их физическими свойствами, изучение условий протекания химических реакций и совершающихся при этом физических явлений. Ныне это разносторонне разветвленная наука, тесно связывающая физику и химию.
Внутри физической химии к настоящему времени выделились и вполне сложились в качестве самостоятельных разделов, обладающих своими особыми методами и объектами исследования, электрохимия, учение о растворах, фотохимия, кристаллохимия. В начале XX века выделилась также в самостоятельную науку выросшая в недрах физической химии коллоидная химия. Со второй половины XX века в связи с интенсивной разработкой проблем ядерной энергии возникла и получила большое развитие новейшая отрасль физической химии - химия высоких энергий, радиационная химия (предметом ее изучения являются реакции, протекающие под действием ионизирующего излучения), химия изотопов.
Вообще физическая химия рассматривается сейчас как наиболее широкий общетеоретический фундамент всей химической науки. Многие ее учения и теории имеют большое значение для развития неорганической и особенно органической химии. С возникновением физической химии изучение вещества стало осуществляться не только традиционными химическими методами исследования, не только с точки зрения его состава и свойств, но и со стороны структуры, термодинамики и кинетики химического процесса, а также со стороны связи и зависимости последнего от воздействия явлений, присущих другим формам движения (световое и радиационное облучение, световое и тепловое воздействие и т.д.).
В первой половине XX века возникает пограничная между химией и новыми разделами физики (квантовая механика, электронная теория атомов и молекул) наука, которую стали позднее называть химической физикой. Она широко применила теоретические и экспериментальные методы новейшей физики к исследованию строения химических элементов и соединений и особенно механизма реакций. Химическая физика изучает взаимосвязь и взаимопереход химической и субатомной форм движения материи.
Постоянно расширяющиеся связи химии и физики привели целый ряд ученых к идее координации и субординации этих наук.
Таким образом, химия XX века предстает перед нами как весьма многообразная и разветвленная система знаний, которая находится в процессе интенсивного развития. В основной своей массе развитие химии идет в виде узкоориентированных прикладных исследований, но вместе с ними сегодня развиваются и концептуальные направления фундаментального характера, которые и определяют статус и положение этой науки в системе современного естествознания. К числу таких концептуальных направлений развития современной химии следует отнести: проблему химического элемента, исследование структуры химических соединений, учение о химических процессах и эволюционную химию.
ПРОБЛЕМА ХИМИЧЕСКОГО ЭЛЕМЕНТА
Концепция химического элемента появилась в химической науке в результате стремления человека обнаружить первоэлемент природы. Она просуществовала более двух тысяч лет. Однако лишь в XVII веке Р. Бойль положил начало современному представлению о химическом элементе как о простом теле, пределе химического разложения вещества, переходящем без изменения из состава одного сложного тела в другое. Тем не менее еще целый век химики делали ошибки в выделении химических элементов. Дело в том, что, сформулировав понятие химического элемента, химики еще не знали ни одного из них. Стремясь получить элементы в чистом виде, они пользовались считавшимся тогда универсальным методом прокаливания - окалину принимали за элемент. Так что известные тогда металлы - железо, медь, свинец - принимали за сложные тела, состоявшие из соответствующего элемента и универсального тела - флогистона. Тем не менее именно флогистонная теория, ложная по сути, оказалась двигателем многих исследований, приведших в конечном итоге к правильным выводам.
Этот вывод был сделан Д.И. Менделеевым, доказавшим, что свойства химического элемента зависят от места данного элемента в периодической системе, определяемого зарядом ядра атома. В XX веке физика помогла установить сложную структуру атома любого химического элемента. Атом представляет собой единую квантово-механическую систему, состоящую из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Выяснены особенности строения электронных орбиталей атомов всех элементов и особая роль внешнего электронного уровня атома, от количества электронов в котором зависит реакционная способность элемента. Наиболее активными с химической точки зрения являются элементы, имеющие минимальную атомную массу и 6-7 электронов на внешнем электронном уровне (фтор, хлор, кислород): они стремятся достроить свою электронную оболочку, присоединив недостающее число электронов; а также металлы, обладающие большой атомной массой и имеющие 1 - 2 электрона на внешнем электронном уровне (барий, цезий), стремящиеся их отдать для его достройки. На этом основано понятие валентности - способности атома к образованию химической связи.
Сегодня науке известно 110 химических элементов, но их удельное содержание в природе крайне неравномерно. Так, 98,6% массы физически доступного слоя Земли составляют всего восемь химических элементов: кислород (47%), кремний (27,5%), алюминий (8,8%), железо (4,6%), кальций (3,6%), натрий (2,6%), калий (2,5%), магний (2,1%). Однако используются эти элементы непропорционально. Например, железа в Земле содержится в два раза меньше, чем алюминия. Но сегодня более 95% всех металлических изделий изготовляются из железно-рудного сырья. Поэтому в современной химии концепция химического элемента выступает как проблема рационального использования химических элементов.
Прежде всего исследования в этой области направлены на изучение и использование силикатов, которые составляют 97% массы земной коры. Отсюда вполне естественно убеждение ученых, что силикаты должны стать основным сырьем для производства всех строительных материалов и полуфабрикатов при изготовлении керамики, способной конкурировать с металлами.
Внимание химиков к этим двум видам материалов не случайно: именно металлы и керамика составляют на 90% современную материально-техническую базу производства. В мире ежегодно производится около 600 млн. тонн металла - более 150 кг на каждого жителя планеты. Примерно столько же производится и керамики вместе с кирпичом. Однако изготовление металла обходится в сотни и тысячи раз дороже, чем керамики. Разница в их стоимости до недавнего времени никого особенно не волновала, так как каждый материал имел свое строго определенное назначение. Но сегодня благодаря химии все больше открывается возможностей для замены металла керамикой. Здесь существенными являются два обстоятельства:
производство керамики намного легче в техническом отношении и выгоднее экономически, а, главное, керамика по своим показателям оказывается более подходящим конструкционным материалом по сравнению с металлом.
Очевидное преимущество керамики состоит в том, что ее плотность на 40% ниже, чем плотность металлов, что позволяет, соответственно, снизить массу изготовляемых из керамики деталей. А при использовании в производстве керамики новых химических элементов - циркония, титана, бора, германия, хрома, молибдена, вольфрама и др. - можно получать керамические изделия с заранее заданными свойствами. Так, в последнее время была синтезирована огнеупорная, термостойкая, высокотвердая керамика с набором заданных электрофизических свойств.
Впервые в мире в 60-х годах в нашей стране был получен сверхтвердый материал - гексанит-Р, представляющий собой одну из разновидностей нитрида бора с температурой плавления 3200 градусов по Цельсию и твердостью, близкой к твердости алмаза. У него отсутствует хрупкость, присущая керамике. Такая керамика производится методом прессования порошков с получением необходимых форм и размеров, что делает ненужной механическую обработку изделий. ,
Еще одно преимущество керамики перед металлами - сверхпроводимость при температуре кипения азота (- 195,8° С). Практическая реализация высокотемпературной сверхпроводимости открывает огромные перспективы для создания сверхмощных двигателей и генераторов, транспортных систем на магнитной подушке, разработки сверхмощных электромагнитных ускорителей и т.п.
Однако подлинный переворот в теории химических элементов произвела химия фторорганических соединений. Она открыла совершенно новый мир органических веществ. Дело в том, что фторуглероды обладают исключительной устойчивостью даже в очень агрессивных средах кислот и щелочей, особой поверхностной активностью, способностью поглощать кислород и перекиси. Поэтому изделия из фторуглерода принимаются в качестве материала для изготовления внутренних органов человека (например, сердечных клапанов, кровеносных сосудов и т.д.).
Синтез уникальных материалов заставляет по-новому исследовать все химические элементы и накапливать данные для новых концепций химических элементов.
КОНЦЕПЦИИ СТРУКТУРЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
Характер любой системы, как известно, зависит не только от состава и строения элементов, но и от их взаимодействия. Именно такое взаимодействие определяет специфические, целостные свойства самой системы. Поэтому при исследовании самих веществ и их реакционной способности химикам приходилось заниматься и изучением их структур. При этом соответственно уровню достигнутых знаний менялись и представления о химической структуре вещества. И хотя в этом направлении химии существовали разные концепции и ученые по-разному истолковывали характер взаимодействия между элементами химических систем, тем не менее все они подчеркивали, что целостные свойства этих систем определяются именно специфическими особенностями взаимодействия между элементами.
Сам термин «структурная химия» - понятие условное. В нем прежде всего подразумевается такой уровень химических знаний, при котором, комбинируя атомы различных химических элементов, можно создать структурные формулы любого химического соединения. Возникновение структурной химии означало, что появилась возможность для целенаправленного качественного преобразования веществ, для создания схемы синтеза любого химического соединения, в том числе и ранее неизвестного.
Во многом развитие этого направления в химии связано с теорией химического строения органических соединений русского химика Александра Михайловича Бутлерова. Его теория позволяла строить структурные формулы любого химического соединения, так как показывала взаимное влияние атомов в структуре молекулы, и таким образом объясняла химическую активность одних веществ и пассивность других. Теория химического строения органических соединений Бутлерова смогла стать для химиков практическим руководством по синтезу органических веществ. Появление этой теории позволило превратить химию из науки аналитической, занимающейся изучением состава готовых веществ, в науку преимущественно синтетическую, способную создавать новые вещества и новые материалы. .
Эта теория наглядно демонстрирует валентность химических элементов как число единиц сродства, присущих
атому -С-; N ; -О-; Н-. Комбинируя атомы различных химических
элементов с их единицами сродства, можно создать структурные формулы любого химического соединения. А это означает, что химик в принципе может создавать план синтеза любого химического соединения - как уже известного, так и еще неизвестного, прогнозировать получение неизвестного соединения и проверить свой прогноз синтезом.
В результате у химиков появился не только энтузиазм, но и уверенность в положительном исходе эксперимента в области органического синтеза. Сам термин «органический синтез» возник в 60 - 80-е годы прошлого века. Он стал обозначать целую область науки, названную так в противоположность общему увлечению анализом природных веществ. Этот период в химии был назван триумфальным шествием органического синтеза. Химики гордо заявляли о своих ничем не сдерживаемых возможностях, обещая синтезировать из угля, воды и воздуха все самые сложные тела вплоть до белков, гормонов и алкалоидов. И действительность, казалось, подтвердила эти заявления: за вторую половину XIX века число изученных органических соединений за счет вновь синтезированных возросло с полумиллиона примерно до двух миллионов.
Но дело в том, что структурная химия ограничена рамками сведений только о молекулах вещества, находящегося в дореакционном состоянии. Этих сведений недостаточно для того, чтобы управлять процессами превращения этого вещества. Так, согласно структурным теориям, должны быть вполне осуществимы многие реакции, которые практически не идут. Большое количество реакций органического синтеза, основанных лишь на принципах структурной химии, имеют столь низкие выходы продукции и такие большие отходы в виде побочных продуктов, что не могут быть использованы в промышленности. К тому же такой синтез требовал в качестве исходного сырья дефицитных активных реагентов и сельскохозяйственной продукции, в том числе и пищевой, что крайне невыгодно в экономическом отношении.
Тем не менее, современная структурная химия достигла больших результатов: большая часть лекарственных препаратов - это продукты органического синтеза. Самым последним ее достижением является открытие совершенно нового класса металлоорганических соединений, которые за свою двухслойную структуру получили название «сэндвичевых соединений». Молекула этого вещества представляет собой две пластины из соединений водорода и углерода, между которыми находится атом какого-либо металла.
Исследования в области современной структурной химии идут по двум перспективным направлениям:
- синтез кристаллов с максимальным приближением к идеальной решетке для получения материалов с высокими техническими показателями: максимальной прочностью, термической стойкостью, долговечностью в эксплуатации и др.;
- создание кристаллов с заранее запрограммированными дефектами для производства материалов с заданными электрическими, магнитными и другими свойствами.
Решение каждой проблемы имеет свои сложности. Так, в первом случае необходимо соблюдение таких условий выращивания кристаллов, которые исключали бы воздействие на процесс внешних факторов, в том числе и поля гравитации (земного притяжения). Поэтому такие кристаллы выращивают на орбитальных станциях в космосе. Решение второй проблемы затруднено тем, что наряду с запрограммированными дефектами практически всегда образуются и нежелательные.
УЧЕНИЕ О ХИМИЧЕСКИХ ПРОЦЕССАХ
Способность к взаимодействию различных химических реагентов определяется кроме всего прочего и условием протекания химических реакций. Эти условия могут оказывать воздействие на характер и результат химических реакций. Наиболее зависимыми от условий протекания реакции оказываются соединения переменного состава с ослабленными связями между их компонентами. Именно на них направлено в первую очередь действие разных катализаторов, которые значительно ускоряют ход химических реакций.
Одним из основоположников этого направления в химии стал русский химик Н.Н. Семенов - лауреат Нобелевской премии, основатель химической физики. В своей Нобелевской лекции 1965 г. он заявил, что химический процесс - то основное явление, которое отличает химию от физики, делает ее более сложной наукой. Химический процесс становится первой ступенью при восхождении от таких относительно простых физических объектов, как электрон, протон, атом, молекула, к живой системе, потому что любая клетка живого организма, по существу, представляет собой своеобразный сложный реактор. Это - мост от объектов физики к объектам биологии.
Подавляющее большинство химических реакций находится во власти стихии. Они трудноконтролируемы: в одних случаях их просто не удается осуществить, хотя они в принципе осуществимы, в других - трудно остановить, например, горения и взрывы, в третьих случаях их трудно ввести в одно желаемое русло, так как они самопроизвольно создают десятки непредвиденных ответвлений с образованием сотен побочных продуктов. В самом общем виде методы управления химическими процессами можно подразделить на термодинамические и кинетические, а среди последних ведущую роль играют каталитические методы.
Выделение химической термодинамики в самостоятельное направление учения о химических процессах обычно связывают с появлением в 1884 г. книги «Очерки по химической динамике» голландского химика Я. Вант-Гоффа. В ней обоснованы законы, устанавливающие зависимость направления химической реакции от изменения температуры и теплового эффекта реакции. Тогда же Ле-Шателье сформулировал свой «принцип подвижного равновесия», вооружив химиков методами смещения равновесия в сторону образования целевых продуктов. Основными рычагами управления реакцией выступают: температура, давление (если реакция происходит в газовой фазе) и концентрация реагирующих веществ (если реакция идет в жидкой фазе).
Каждая химическая реакция в принципе обратима, но на практике равновесие смещается в ту или иную сторону, что зависит как от природы реагентов, так и от условий процесса. Есть реакции, которые не требуют особых средств управления:
кислотно-основное взаимодействие (нейтрализация), реакции, сопровождающиеся удалением готовых продуктов или в виде газов, или в форме осадков. Но существует немало реакций, равновесие которых смещено влево, к исходным веществам. И чтобы их осуществить, требуются особые термодинамические рычаги - увеличение температуры, давления и концентрации реагируемых веществ.
Термодинамическое воздействие влияет преимущественно на направленность химических процессов, а не на их скорость. Управлением скоростью химических процессов занимается химическая кинетика, в которой изучается зависимость протекания химических процессов от различных структурно-кинетических факторов: строения исходных реагентов, их концентрации, наличия в реакторе катализаторов и других добавок, способов смешения реагентов, материала и конструкции реактора и т.п.
Задача исследования химических реакций является исключительно сложной. Ведь при ее решении необходимо выяснить механизм взаимодействия не просто двух реагентов, а еще и «третьих тел», которых может быть несколько. В этом случае наиболее целесообразно поэтапное решение, при котором вначале выделяется наиболее сильное действие какого-нибудь одного из «третьих тел», чаще всего катализатора.
Здесь следует понять, что практически все химические реакции представляют собой отнюдь не простое взаимодействие исходных реагентов, а сложные цепи последовательных стадий, где реагенты взаимодействуют не только друг с другом, но и со стенками реактора, которые могут как катализировать (ускорять), так и ингибировать (замедлять) процесс.
Опыты показывают, что на интенсивность химических процессов оказывают влияние также случайные примеси. Вещества различной степени чистоты проявляют себя в одних случаях как более активные реагенты, в других - как инертные. Примеси могут оказывать как каталитическое, так и ингибиторное действие. Поэтому для управления химическим процессом в реагирующие вещества вносят те или иные добавки.
Таким образом, влияние «третьих тел» на ход химических реакций может быть сведено к катализу, то есть положительному воздействию на химический процесс, и к ингибированию, сдерживающему процесс.
Катализ в химии делает настоящие чудеса. Например, реакция синтеза аммиака. До 1913 г. она вообще не могла быть осуществлена. Только после того, как был найден катализатор, при высокой температуре и давлении эту реакцию удалось осуществить. Но она была очень трудной в технологическом исполнении и опасной. А сейчас открыты условия, позволяющие проводить ее при нормальном давлении и комнатной температуре с использованием металлоорганических катализаторов.
Применение катализаторов послужило основанием коренной ломки всей химической промышленности. Благодаря им стало возможным ввести в действие в качестве сырья для органического синтеза парафины и циклопарафины, до сих пор считавшиеся «химическими мертвецами». Катализ находится в основании производства маргарина, многих пищевых продуктов, а также средств защиты растений. Почти вся промышленность основной химии (производство неорганических кислот, оснований и солей) и «тяжелого органического синтеза», включая получение горюче-смазочных материалов, базируется на катализе. Последнее время тонкий органический синтез также становится все более каталитическим. 60 - 80 процентов всей химии основаны на каталитических процессах. Химики не без основания говорят, что некаталитических процессов вообще не существует, поскольку все они протекают в реакторах, материал стенок которых служит своеобразным катализатором. Но сам катализ долгое время оставался загадкой природы, вызывая к жизни самые разнообразные теории, как чисто химические, так и физические.
Эти теории, даже будучи ошибочными, оказывались полезными хотя бы потому, что наталкивали исследователей на новые эксперименты. Ведь дело было в том, что для большинства промышленно важных химических процессов катализаторы подбирались путем бесчисленных проб и ошибок. Так, например, для вышеназванной реакции синтеза аммиака в 1913 - 1914 годах немецкие химики испробовали в качестве катализатора более 20 тысяч химических соединений, следуя периодической системе элементов и сочетая их самыми разными способами.
Сегодня можно сделать некоторые выводы о сущности катализа:

Если же реакцию проводят в отсутствие катализатора, то активация молекул реагирующих веществ должна происходить за счет подачи в реактор энергии извне.
2. В общем случае любую каталитическую реакцию можно представить проходящей через промежуточный комплекс, в котором происходит перераспределение ослабленных химических связей
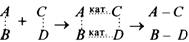
3. В подавляющем большинстве случаев в качестве катализаторов выступают соединения бертоллидного типа -соединения переменного состава, отличающиеся наличием в них ослабленных химических связей или даже свободных валентностей, что придает им высокую химическую активность. Их молекулы содержат широкий набор энергетически неоднородных связей или даже свободные атомы на поверхности.
4. Следствием взаимодействия реагентов с катализатором является ход реакции в заданном направлении; увеличение скорости реакции, так как на поверхности катализатора увеличивается число встреч реагирующих молекул; захват катализатором некоторой части энергии экзотермической реакции для энергетической подпитки все новых актов реакции и ее общего ускорения.
На современном этапе своего развития учение о химических процессах занимается разработкой таких проблем, как химия плазмы, радиационная химия, химия высоких давлений и температур.
Химия плазмы изучает химические процессы в низкотемпературной плазме (плазма - это ионизированный газ). Она исследует протекание химических реакций при температурах от 1000 до 10000° С. Такие процессы характеризуются возбужденным состоянием частиц, столкновениями молекул с заряженными частицами и очень высокими скоростями реакций.
В плазмохимических процессах скорость перераспределения химических связей очень высока: длительность элементарных актов химических превращений составляет 10-13сек при почти полном отсутствии обратимости реакции. Скорость этих химических процессов в обычных реакторах из-за обратимости снижается в тысячи раз. Поэтому плазмохимические процессы очень производительны.
Плазменная химия в последнее время все больше внедряется в промышленное производство. Уже созданы технологии производства сырья для порошковой металлургии, разработаны методы синтеза для целого ряда химических соединений. В 70-х годах были созданы плазменные сталеплавильные печи, позволяющие получать самые высококачественные металлы. Разработаны методы ионно-плазменной обработки поверхности инструментов, износостойкость которых увеличивается в несколько раз.
Плазмохимия позволяет синтезировать ранее неизвестные материалы, такие как металлобетон, в котором в качестве связующего элемента используются различные металлы. При сплавлении частиц горной породы благодаря прочному сжатию их с металлом образуется металлобетон, превосходящий по своим качествам обычный бетон в десятки и сотни раз.
Одним из самых молодых направлений в исследовании химических процессов является радиационная химия, которая зародилась во второй половине нашего столетия. Предметом ее разработок стали превращения самых разнообразных веществ под воздействием ионизирующих излучений. Источниками ионизирующего излучения служат рентгеновские установки, ускорители заряженных частиц, ядерные реакторы, радиоактивные изотопы. В результате радиационно-химических реакций вещества получают повышенную термостойкость и твердость.
Наиболее важными процессами радиационно-химической технологии являются полимеризация, вулканизация, производство композиционных материалов, в том числе получение полимербетонов путем пропитки обычного бетона каким-нибудь полимером с последующим облучением. Такие бетоны имеют в 4 раза более высокую прочность, обладают водонепроницаемостью и высокой коррозийной стойкостью.
Сегодня также принципиально новой и исключительно важной областью учения о химических процессах является самораспространяющийся высокотемпературный синтез тугоплавких и керамических материалов. Обычно их производство осуществляется методом порошковой металлургии, суть которого заключается в прессовании и сжатии при высокой температуре (1200 - 2000° С) металлических порошков. Самораспространяющийся синтез происходит гораздо проще, так как основан на реакции горения одного металла в другом, или металла в азоте, углероде и т.п.
Сегодня абсолютно точно известно, что процесс горения представляет собой соединение кислорода с горючим веществом. В химии принято считать горение реакцией окисления горючего вещества, что означает перемещение электронов от атомов горючего тела к атомам кислорода. С этой точки зрения горение возможно не только в кислороде, но и в других окислителях. На этом выводе и основан самораспространяющийся высокотемпературный синтез - тепловой процесс горения в твердых телах. Он представляет собой, например, горение порошка титана в порошке бора, или порошка циркония в порошке кремния. В результате такого синтеза получаются сотни тугоплавких соединений самого высокого качества.
ЭВОЛЮЦИОННАЯ ХИМИЯ
Еще до недавнего времени, до 50 - 60-х гг. об эволюционной химии ничего не было известно. В отличии от биологов, которые вынуждены были использовать эволюционную теорию Дарвина для объяснения происхождения многочисленных видов растений и животных, химиков вопрос о происхождении вещества не волновал, потому что получение любого нового химического индивида всегда было делом рук и разума человека: молекула нового химического соединения конструировалась по законам структурной химии из атомов и атомных групп, как здание из кирпичей. Живые же организмы из блоков собрать нельзя.
Возникновению эволюционной химии способствовали исследования в области моделирования биокатализаторов. Искусственный выбор каталитических структур ориентировался на естественную, осуществляемую природой эволюцию от неорганической химии к живым системам. Другим основанием для развития исследований в области эволюционной химии являются реальные достижения «нестационарной кинетики».
В результате этих достижений у химиков появилась возможность решать эволюционные проблемы применительно к своим объектам. Это проблемы самопроизвольного (без участия человека) синтеза новых химических соединений, являющихся более высокоорганизованными продуктами по сравнению с исходными веществами. Поэтому эволюционную химию считают предбиологией - наукой о самоорганизации и саморазвитии химических систем.
ВЗАИМОСВЯЗЬ ХИМИИ С БИОЛОГИЕЙ
Химия и биология долгое время шли каждая своим собственным путем, хотя давней мечтой химиков было создание в лабораторных условиях живого организма.
Сама по себе эта идея возникла еще в период алхимии и вплоть до XVI века была одной из главных целевых установок. Однако к XVII веку среди ученых утвердилось убеждение о неосуществимости и, следовательно, ложности идеалов алхимии. Такой переоценке способствовали те положительные знания, которые были накоплены в результате развития самой алхимии. В результате были дискредитированы такие направления алхимии, как поиски «философского камня» и универсального растворителя. Третий же идеал алхимии -эликсир долголетия, - не потерял своей популярности благодаря применению химических препаратов для сохранения здоровья и лечения болезней.
Тем не менее «биологические идеалы» ранних этапов становления химического знания определили устойчивую традицию обращения химиков к проблемам биологии, хотя тогда же сложились представления о непроходимой грани между живым и неживым.
Процесс взаимодействия химии и биологии значительно усилился в начале XIX века, когда в составе химии образовались две самостоятельные научные дисциплины - неорганическая и органическая химия. Применительно к вопросу взаимодействия химии и биологии наибольший интерес представляет органическая химия.
Органическая природа предоставила химикам-органикам прекрасные образцы своего творения - вещества растительного и животного происхождения - для подражания и воспроизведения подобных веществ в химических лабораториях. Так для химиков возник «биологический идеал», оказавший большое влияние на развитие органической химии, особенно на первоначальном этапе ее становления.
Резкое укрепление взаимосвязи химии с биологией произошло в результате создания А.М. Бутлеровым теории химического строения органических соединений. Руководимые этой теорией химики-органики вступили в соревнование со своей «соперницей» - природой. Последующие поколения химиков проявили большую изобретательность, труд, фантазию и творческий поиск в направленном синтезе вещества. Их замыслом было не только подражать природе, они хотели превзойти ее. И сегодня мы можем уверенно заявить, что во многих случаях это удалось.
Лишь постепенное развитие науки XIX века, приведшее к раскрытию структуры атома и детальному познанию строения и состава клетки, открыло перед химиками и биологами практические возможности совместной работы над химическими проблемами учения о клетке, среди них вопросы о характере химических процессов в живых тканях, об обусловленности биологических функций химическими реакциями.
Действительно, если посмотреть на обмен веществ в организме с чисто химической точки зрения, как это сделал А.И. Опарин, мы увидим совокупность большого числа сравнительно простых и однообразных химических реакций, которые сочетаются между собой во времени, протекают не случайно, а в строгой последовательности, в результате чего образуются длинные цепи реакций. И этот порядок закономерно направлен к постоянному самосохранению и самовоспроизведению всей живой системы в целом в данных условиях окружающей среды.
Таким образом, такие специфические свойства живого, как рост, размножение, подвижность, возбудимость, способность реагировать на изменения внешней среды, связаны с определенными комплексами химических превращений.
Поэтому химии среди наук, изучающих жизнь, принадлежит основная роль. Именно химией выявлена важнейшая роль хлорофилла как химической основы фотосинтеза, гемоглобина как основы процесса дыхания, установлена химическая природа передачи нервного возбуждения, определена структура нуклеиновых кислот и т.д. Но главное заключалось в том, что объективно в самой основе биологических процессов, функций живого лежат химические механизмы. Все функции и процессы, происходящие в живом организме, оказывается возможным изложить на языке химии, в виде конкретных химических процессов.
Конечно, было бы неверным сводить явления жизни к химическим процессам. Это было бы грубым механистическим упрощением. И ярким свидетельством этого выступает специфика химических процессов в живых системах по сравнению с неживыми. Изучение этой специфики раскрывает единство и взаимосвязь химической и биологической форм движения материи. Об этом же говорят и другие науки, возникшие на стыке биологии, химии и физики: биохимия - наука об обмене веществ и химических процессов в живых организмах;
биоорганическая химия - наука о строении, функциях и путях синтеза соединений, составляющих живые организмы; физико-химическая биология как наука о функционировании сложных систем передачи информации и регулировании биологических процессов на молекулярном уровне, а также биофизика, биофизическая химия и радиационная биология.
Научными достижениями этого процесса стало определение химических продуктов клеточного метаболизма (обмена веществ в растениях, животных, микроорганизмах); установление биологических путей и циклов биосинтеза этих продуктов, был реализован их искусственный синтез, открытие материальных основ регулятивного и наследственного молекулярного механизма, а также в значительной степени выяснено значение химических процессов в энергетике процессов клетки и вообще живых организмов.
Сейчас для химии особенно важным становится применение биологических принципов, в которых сконцентрирован опыт приспособления живых организмов к условиям Земли в течение многих миллионов лет, опыт создания наиболее совершенных механизмов и процессов. Об этом следует поговорить подробнее.
Еще в XIX веке ученые поняли, что основой исключительной эффективности биологических процессов является биокатализ. Поэтому химики ставят своей целью создать новую химию, основанную на каталитическом опыте живой природы. Появится новое управление химическими процессами, где начнут применяться принципы синтеза себе подобных молекул, по принципу ферментов будут созданы катализаторы с таким разнообразием качеств, которые далеко превзойдут существующие в нашей промышленности.
Несмотря на то, что ферменты обладают общими свойствами, присущими всем катализаторам, тем не менее они не тождественны последним, поскольку функционируют в рамках живых систем. Поэтому все попытки использовать опыт живой природы для ускорения химических процессов в неорганическом мире сталкиваются с серьезными ограничениями. Пока речь может идти только о моделировании некоторых функций ферментов и использовании этих моделей для теоретического анализа деятельности живых систем, а также частично-практического применения выделенных ферментов для ускорения некоторых химических реакций.
Здесь самым перспективным направлением, очевидно, являются исследования, ориентированные на применение принципов биокатализа в химии и химической технологии, для чего нужно изучить весь каталитический опыт живой природы, в том числе и опыт формирования самого фермента, клетки и даже организма. Здесь и возникли основы эволюционной химии как новой науки, пролагающей пути принципиально новой химической технологии, способной стать аналогом живых систем.
Тот факт, что катализ играл решающую роль в процессе перехода от химических систем к биологическим, то есть на предбиологической стадии эволюции, в настоящее время подтверждается многими данными. Такие реакции сопровождаются образованием специфических пространственных и временных структур за счет образования новых и удаления использованных химических реагентов. Однако в отличие от самоорганизации открытых физических систем в данных химических реакциях важное значение приобретают каталитические процессы.
Роль этих процессов усиливается по мере усложнения состава и структуры химических систем. Именно на этом основании некоторые ученые напрямую связывают химическую эволюцию с самоорганизацией и саморазвитием каталитических систем. Иными словами, такая эволюция если не целиком, то в значительной мере связана с процессами самоорганизации каталитических систем. Здесь, однако, следует помнить, что переход к простейшим формам жизни предполагает также особый дифференцированный отбор лишь таких химических элементов и их соединений, которые являются основным строительным материалов для образования биологических систем. Такие элементы в химии получили название органогенов.
В результате такого подхода появилась информация об отборе химических элементов и структур, который оказался подобен биологической эволюции. В настоящее время химической наукой открыто 110 химических элементов. Большинство из них попадает в живые организмы и участвует в их жизнедеятельности. Однако основу жизнедеятельности организмов обеспечивает только шесть химических элементов-органогенов. Это углерод, водород, кислород, азот, фосфор и сера. Их суммарная весовая доля в структуре живого организма составляет 97,4%. За ними по степени важности следуют 12 элементов, которые принимают участие в построении многих физиологически важных компонентов биологических систем. Это натрии, калий, кальций, магний, алюминий, железо, кремний, хлор, медь, цинк, кобальт, никель. Их весовая доля в организме составляет 1,6%. Кроме того есть еще 20 элементов, которые участвуют в построении и функционировании отдельных узко-специфичных биосистем и весовая доля которых составляет около 1%. Все остальные элементы в построении биосистем практически не участвуют.
Общая картина химического мира также весьма убедительно свидетельствует об отборе элементов. В настоящее время химической науке известно около 8 млн. химических соединений. Из них подавляющее большинство (96%) составляют органические соединения, которые образованы на основе все тех же 6 - 18 элементов. А из остальных 95 - 99 химических элементов природа создала всего лишь 300 тысяч неорганических соединений. Из органогенов на Земле наиболее распространены кислород и водород. Степень распространенности углерода, азота, фосфора и серы в поверхностных слоях Земли примерно одинакова и в общем невелика - около 0,24 весовых процента. В космосе безраздельно господствуют только два элемента - водород и гелий, а остальные элементы можно рассматривать только как добавки к ним.
Такая резкая диспропорция между органическими и неорганическими соединениями, а также исключительно дифференцированный отбор минимума органогенов не могут быть объяснены различной распространенностью химических элементов в космосе и на Земле.
Это означает, что определяющими факторами в отборе химических элементов при формировании органических систем, а тем более биосистем выступают условия соответствия этих элементов определенным требованиям:
1. Способность образовывать прочные и, следовательно, энергоемкие химические связи.
2. Эти связи должны быть лабильны (то есть способны к образованию новых разнообразных связей).
Вот поэтому углерод и отобран из многих других элементов как органоген номер один. Он, как никакой другой элемент, способен вмещать и удерживать внутри себя самые редкие химические противоположности, реализовывать их единство, выступать в качестве носителя внутреннего противоречия.
О том, как происходит отбор структур, каков его механизм, сказать довольно трудно. Но этот процесс оставил нам своего рода музей. Подобно тому, как из всех химических элементов только 6 органогенов да 10 - 15 других элементов отобраны природой, чтобы составить основу биосистем, так же в результате эволюции шел тщательный отбор химических соединений.
Из миллионов органических соединений в построении живого участвуют лишь несколько сотен, из 100 известных аминокислот в состав белков входит только 20, лишь по четыре нуклеотида ДНК и РНК лежат в основе всех сложных полимерных нуклеиновых кислот, ответственных за наследственность и регуляцию белкового синтеза в любых живых организмах.
Сегодня ясно, что в ходе эволюции отбирались те структуры, которые способствовали резкому повышению активности и селективности действия каталитических групп. Есть уже и некоторые выводы:
1. На ранних этапах химической эволюции мира катализ вовсе отсутствует. Условия высоких температур (более 5000 К), электрических разрядов и радиации, с одной стороны, препятствуют образованию конденсированного состояния, а с другой -с лихвой перекрывают те порции энергии, которые необходимы для преодоления энергетических барьеров.
2. Первые проявления катализа начинаются при смягчении условий и образовании первичных твердых тел.
3. По мере того, как физические условия приближались к земным, роль катализатора возрастала. Но общее значение катализа вплоть до образования более или менее сложных органических молекул все еще не могло быть высоким.
4. Роль катализа в развитии химических систем после достижения стартового состояния, то есть известного количественного минимума органических и неорганических соединений, начала возрастать с фантастической быстротой.
Теория саморазвития элементарных открытых каталитических систем, в самом общем виде выдвинутая профессором МГУ А.П. Руденко в 1964 г., является общей теорией химической эволюции и биогенеза. Она решает вопросы о движущих силах и механизмах эволюционного процесса, то есть о законах химической эволюции, об отборе элементов и структур и их причинной обусловленности, о высоте химической организации и иерархии химических систем как следствии эволюции.
Сущность этой теории состоит в том, что химическая эволюция представляет собой саморазвитие каталитических систем и, следовательно, эволюционирующим веществом являются катализаторы. В ходе реакции происходит естественный отбор тех каталитических центров, которые обладают наибольшей активностью. Саморазвитие, самоорганизация и самоусложнение каталитических систем происходит за счет постоянного притока трансформируемой энергии. А так как основным источником энергии является базисная реакция, то максимальные эволюционные преимущества получают каталитические системы, развивающиеся на базе экзотермических реакций. Отсюда базисная реакция является не только источником энергии, но и орудием отбора наиболее прогрессивных эволюционных изменений катализаторов.
Тем самым А.П. Руденко сформулировал основной закон химической эволюции, согласно которому с наибольшей скоростью и вероятностью образуются те пути эволюционных изменений катализатора, на которых происходит максимальное увеличение его абсолютной активности.
Практическим следствием теории саморазвития открытых каталитических систем является так называемая «нестационарная технология», то есть технология с меняющимися условиями реакции. Сегодня исследователи приходят к выводу, что стационарный режим, надежная стабилизация которого казалась залогом высокой эффективности промышленного процесса, является лишь частным случаем нестационарного режима. При этом обнаружено множество нестационарных режимов, способствующих интенсификации реакции.
Сегодня уже совершенно ясны перспективы создания и развития новой химии, на основе которой будут созданы малоотходные, безотходные и энергосберегающие промышленные технологии.
План семинарского занятия (2 часа)
1. Химия как наука. Структура химии.
2. Взаимосвязь химии и физики. Тепловой эффект химической реакции.
3. Проблема химического элемента. Реакционная способность вещества.
4. Структурная химия, ее современные задачи.
5. Учение о химическом процессе. Катализ.
6. Эволюционная химия. Связь химии и биологии. Теория А.П.Руденко.
Темы докладов и рефератов
1. Рассказ об открытии редких химических'элементов.
2. Новые материалы в химии и возможность их применения.
ЛИТЕРАТУРА
1. Будрейко Н.А. Философские вопросы химии. М., 1970.
2. Васильева Т. С/, Орлов В.В. Химическая форма материи. М., 1983.
3. Данцев А. А. Философия и химия. Ростов-на-Дону, 1991.
4. Кузнецов В.И. Диалектика развития химии. М., 1973.
5. Кузьменко Н.Е., Еремин В.В. Химия. Ответы на вопросы. М., 1997.
6. ПиментелДж., КунродДж. Возможности химии сегодня и завтра. М., 1992.
7. Помер 3. Химия на пути в третье тысячелетие. М., 1982.
8. Соловьев Ю.И. Эволюция основных теоретических проблем химии. М., 1971.
9. Соловьев Ю.И., Курашов В.И. Химия на перекрестке наук. М., 1989.
10. Фигуровский Н.А. История химии. М., 1979.
11. Химия и мировоззрение. М., 1986.
.
Ваш комментарий о книге
Обратно в раздел Наука
|
|
