Библиотека
Теология
Конфессии
Иностранные языки
Другие проекты
|
Ваш комментарий о книге
Бондарев В. Концепции современного естествознания
Глава 7 ХИМИЧЕСКИЕ ПРЕОБРАЗОВАНИЯ ВЕЩЕСТВА
§7.1. Химические явления и их сущность
Сущность химических явлений
Изучение химических явлений основывается на фундаментальных принципах физической картины мира и вносит большой вклад в описание явлений живой и неживой природы.
Простейшим носителем химических свойств служит атом (в том числе ионизированный) — система, состоящая из ядра и движущихся вокруг него (в его электрическом поле) электронов. В результате химического взаимодействия атомов образуются молекулы (радикалы, ионы, атомные кристаллы) - системы, состоящие из нескольких ядер, в общем поле которых движутся электроны. При химическом взаимодействии молекул одна конфигурация ядер и электронов разрушается и образуется новая. Акт химического взаимодействия состоит в образовании новых электронных (молекулярных) орбиталей.
В химических реакциях участвуют не отдельные частицы, а их большие коллективы — вещества, причем химическое изменение сопровождается появлением новых химических индивидов, или химических веществ. Химическим индивидом обычно называют наименьшее количество вещества, повторением которого в пространстве можно воспроизвести данное вещество. Таким образом, химическими индивидами будут атомы в атомной решетке простого вещества (поэтому графит и алмаз, которые содержат атомы углерода С в своих кристаллических решетках, являются одним и тем же химическим индивидом) или группы атомов в составе сложного атомного вещества (SiC в решетке карбида кремния), молекулы в веществе молекулярного строения (Н2О в воде), ионные пары или более сложные ионные комплексы в ионном веществе (NaCl в поваренной соли, Na2CO3·10Н2О в кристаллической соде) и т.д. При таком определении изменение агрегатного состояния, полиморфный переход, механическое разрушение, образование некоторых растворов (например, газовых) нельзя назвать химическими явлениями.
Химические явления определяют развитие неживой и живой природы и отличаются от других, рассматриваемых в естествознании. Так, геолого-географические явления отличаются от химических участием во взаимодействии не веществ, а вещественных систем в литосфере, атмосфере, гидросфере и т.д., а также макромасштабами взаимодействий. Увеличение количества (массы) реагирующих участников процесса приводит к новым, отсутствующим в химии, закономерностям; примером может служить несмешиваемость вод Гольфстрима с окружающими их водами северных морей. Один из простейших носителей биологических явлений - клетка. В отличие от химических реакций, протекающих в неживых системах и основанных на статистических столкновениях беспорядочно распределенных в пространстве молекул, в клетке реагируют молекулы, пространственно закрепленные на матрице. Следовательно, в первом приближении есть возможность выделить химические явления среди других.
Изучение химических явлений требовалось человеку преимущественно для того, чтобы получать из природных веществ все необходимые ему материалы - металлы и керамику, известь и цемент, стекло и бетон, красители и фармацевтические препараты и т.д. Поэтому все химические знания объединяет главная задача — получение веществ с заданными свойствами. Чтобы реализовать эту задачу, надо уметь из одних веществ производить другие, т.е. осуществлять их качественные превращения. А поскольку качество - это совокупность свойств вещества, то следует знать, как именно управлять его свойствами, знать, от чего они зависят; иначе говоря, требуется решать проблему генезиса свойств вещества. В различные исторические эпохи эта проблема решалась по-разному.
Основные концептуальные системы химии
При всем многообразии химических явлений выделяют четыре основные концептуальные системы [15]. Эти системы появлялись последовательно во времени, причем каждая новая химическая концепция возникала на основе научных достижений предыдущей (рис. 7.1).
Первая химическая концепция - учение о составе - возникла в 1660-х гг. и связана с исследованием свойств веществ в зависимости от их химического состава. В период с середины XVII до второй половины XIX в. учение о составе веществ представляло собой практически всю химию. В настоящее время в ее рамках рассматриваются проблемы периодичности, стехиометрии (соотношения между количествами вступивших в реакцию реагентов и образующихся продуктов), а также физико-химический анализ как основа изучения многокомпонентных систем на основе построения диаграмм состав-свойство.
В 1800-е гг., когда стало очевидным, что свойства веществ и их качественное разнообразие обусловливаются не только составом, но и структурой молекул, возникла концепция структурной химии, предполагающая исследование структуры, т.е. способа взаимодействия элементов. Эта концепция опирается на атомно-молекулярную концепцию строения вещества. Развитие современной структурной химии связано с познанием в области квантово-механической теории строения атома, химической связи и строения вещества.
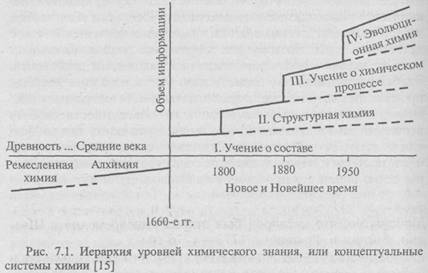
Третья концептуальная система - учение о химическом процессе - в 1950-е гг. завершает свой этап становления. В основании ее лежит представление о химической кинетике и химической термодинамике, а в ее рамках исследуются внутренние механизмы и условия протекания химических процессов (скорости протекания процессов, температура, давление и т.п., влияние катализаторов, ингибиторов и пр.).
Идеи четвертой концептуальной системы — эволюционной химии,- были сформулированы в 1970-х гг. Эта система находится в стадии становления. В центре ее внимания — открытые высокоорганизованные химические системы, развитие которых приводит к возникновению биологической формы движения. Эволюционная химия включает в себя учение об эволюционном катализе (теории саморазвития химических систем), а также теории биоорганической и бионеорганической химии.
§ 7.2. Химический состав вещества
Проблема химического элемента
Химический состав вещества рассматривается в рамках учения о составе, в котором обычно выделяют три основных проблемы: проблему химического элемента, проблему химического соединения, проблему вовлечения химических элементов в производство новых материалов [15, 16].
В настоящее время под химическим элементом понимают совокупность атомов с одинаковым зарядом ядра. Начало современному представлению о химическом элементе как о «простом теле» или как о пределе химического разложения вещества, переходящем без изменения из состава одного сложного тела в состав другого, первым положил Р. Бойль в середине XVII в. Химики того времени не знали ни одного химического элемента. Фосфор был открыт только в 1669 г., а потом повторно в 1680 г., кобальт - в 1735 г., никель - в 1751 г., водород — в 1766 г., фтор - в 1771 г., азот — в 1772 г., хлор и марганец — в 1774 г. Любопытно, что кислород был открыт одновременно в Швеции, Англии и Франции в 1772 - 1776 гг.
Установив роль кислорода в образовании кислот, оксидов и воды, А.Л. Лавуазье опроверг господствовавшую в химии ХУШ в. ложную теорию флогистона, согласно которой флогистон («огненная материя») содержался во всех горючих веществах и выделялся из них при горении. На основании своего открытия Лавуазье создал принципиально новую теорию химии. Ему принадлежит первая в истории попытка систематизации химических элементов. Он включил в свою систему кислород, водород, азот, серу, фосфор, углерод, семь известных к тому времени металлов, но также известь, магнезию, глинозем и кремнезем, мотивируя это тем, что они не поддавались дальнейшему разложению.
Дальнейшие попытки систематизации химических элементов привели Д.И. Менделеева к его великому открытию. Он предложил считать показателем химического элемента его место в Периодической системе элементов, определяемое по атомной массе. Свою систему Менделеев создал на основе открытого им периодического закона. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер. Заряд ядра Z равен атомному (порядковому) номеру элемента в системе. Элементы, расположенные по возрастанию Z (H, Не, Li, Be...), образуют семь периодов. В 1-м - два элемента (Н, Не), во 2-м и 3-м - по восемь, в 4-м и 5-м - по 18, в 6-м - 32, в 7-м периоде известны 24 элемента (на 1999 г.). В периодах свойства элементов закономерно изменяются при переходе от щелочных металлов к благородным газам. Вертикальные столбцы — группы элементов, сходных по свойствам. Внутри групп свойства элементов также изменяются закономерно (например, у щелочных металлов при переходе от Li к Fr возрастает химическая активность). Элементы с Z = 58-71, а также с Z = 90—103, особенно сходные по свойствам, образуют два семейства - соответственно лантаноидов и актиноидов. Периодичность свойств элементов обусловлена периодическим повторением конфигурации внешних электронных оболочек атомов. С положением элемента в системе связаны его химические и многие физические свойства.
Открытие периодического закона стимулировало поиск новых химических элементов. Так, если во времена Менделеева были известны 62 элемента, то уже в 1930-е гг. система элементов заканчивалась ураном (Z = 92). В дальнейшем элементы открывались путем физического синтеза атомных ядер - Тс, Pm, At, Fr, Np, Pu и элементы после Z = 95 включительно, причем Тс, Pm, Fr, Np позже в ничтожных количествах обнаружены в природе. В настоящее время самым тяжелым синтезированным элементом является элемент с Z = 112. Далее элементы оказываются неустойчивыми. Однако ученые предполагают, что могут быть «островки устойчивости» при Z = 126, 164 и даже 184.
Полное научное объяснение Периодической системы элементов базируется на законах квантовой механики. Система Менделеева лежит в основе современного учения о строении вещества, играет первостепенную роль в изучении всего многообразия химических веществ и в синтезе новых элементов.
Проблема химического соединения
Под химическим соединением в настоящее время понимают индивидуальное вещество, в котором атомы одного (например, N2 и СЬ) или различных (HbSCU, KC1) элементов соединены между собой химической связью. Сейчас известно свыше 5 млн химических соединений. Состав химических соединений в огромном большинстве случаев подчиняется законам постоянства состава и кратных отношений. Первый закон, открытый Ж.Л. Прустом в начале XIX в., гласит, что каждое химически чистое соединение независимо от способа и места его получения имеет один и тот же постоянный состав, причем отношения масс атомов элементов постоянны. В соответствии с законом кратных отношений, открытым Дж. Дальтоном в начале XIX в., если два химических элемента образуют друг с другом более одного соединения, то массы одного элемента, приходящиеся на одну и ту же массу другого, относятся как целые числа, обычно небольшие. Так, в оксидах азота N2O, NO, N2О3, N2О4, N2О5 соотношения массы кислорода к массе азота составляют 1:2:3:4:5.
Проблема химического соединения до недавнего времени не вызывала споров у ученых. Было общепринято, что нужно относить к химическим соединениям, а что - к «простым телам», или смесям. Однако применение современных физических методов исследования вещества обнаружило физическую природу химизма, а именно: атомы объединяют в молекулы как единую квантово-механическую систему внутренние силы - химические связи, а они представляют собой проявление волновых свойств валентных электронов.
Волновая природа электронов наделяет атомы их типичными свойствами. Наименьшими единицами многих веществ служат не атомы, а молекулы, т.е. группы атомов, тесно связанных друг с другом. Чтобы понять строение вещества, следует узнать не только строение атома, но и причину соединения атомов в молекулы - химическую связь. Квантовая механика дала объяснение химической связи: она возникает между атомами в результате взаимодействия электронных конфигураций различных атомов, причем тогда, когда эти конфигурации хорошо подходят друг другу, как зубцы шестерни или пазлы в головоломке. Конфигурации смешиваются и переплетаются, когда атомы приведены в соприкосновение, вследствие чего появляются новые конфигурации. Если атомные конфигурации очень хорошо подходят друг другу, при их сближении возникает одна крупная округлая единица, но только несколько большая и более компактная - насыщенная молекула, не присоединяющая других атомов. Например, два атома водорода, каждый с простейшей электронной конфигурацией, образуют молекулу водорода, в которой обе электронные конфигурации сливаются в одну эллиптическую.
Таким образом, химическая связь в своей основе имеет электрическую природу. Ее прочность обусловлена квантовой устойчивостью совокупной электронно-волновой картины образовавшейся молекулы. Поскольку существуют многочисленные способы соединения и переплетения электронных конфигураций, существует множество химических соединений разных типов.
В результате раскрытия физической сущности химической связи классическое понятие молекулы изменилось. Молекулой по-прежнему называют наименьшую частицу вещества, способную определять его свойства и существовать самостоятельно. Но теперь в число молекул включают и такие квантово-механические системы, как ионные, атомные и металлические монокристаллы и полимеры, образованные за счет водородных связей. Поэтому некоторые неорганические вещества (оксиды, хлориды, сульфиды, нитриды металлов) относят к веществам молекулярного строения, не имеющим постоянного состава.
Дело в том, что реальные монокристаллы любых твердых веществ всегда имеют дефекты: вакантные узлы кристаллической решетки; атомы, попавшие в междоузлия; дислокации как отклонения от геометрических норм данной кристаллической решетки и т.д. Именно они становятся реакционными центрами при вхождении твердого вещества в химические реакции. Помимо химической связи, которая держит атомы связанными в молекулы, существуют межмолекулярные силы. Они слабее химической связи, но именно они определяют агрегатное состояние вещества. Когда две молекулы сближаются, электронные конфигурации каждой из них стремятся колебаться в унисон. Благодаря этому возникает притяжение (так называемые ван-дер-ваальсовы силы), сила которого зависит от типа движения электрона.
Межмолекулярные силы держат молекулы близко друг от друга, т.е. они ответственны за агрегацию молекул. В жидких и твердых веществах молекулы как бы «слипаются», а в газах каждая движется сама по себе. Агрегатное состояние вещества сильно зависит от температуры: при очень низких температурах почти все вещества становятся твердыми, при очень высоких все переходят в газообразное состояние, а при промежуточных температурах они находятся в жидком состоянии. Значения температур, при которых происходят эти превращения (точка плавления, точка кипения), зависят от силы притяжения между молекулами.
При очень низких температурах тепловое движение незначительно, поэтому молекулы «выстраиваются» в строго правильные ряды и удерживаются в таком виде межмолекулярными силами — образуется твердое тело. Правильное расположение молекул проявляется в кристаллах - твердых телах, в которых правильное расположение атомов сохраняется в больших объемах и проявляется в виде прямых ребер и правильно расположенных граней и вершин. Если попытаться деформировать кристалл, изгибая или ломая его, чувствуется сопротивление - при перемене взаимного расположения атомов надо преодолеть межмолекулярные силы, которые удерживают атомы в определенных местах.
Молекулы и атомы в твердых телах столь близки, что часто сливаются. При этом соседние электронные конфигурации перекрываются так сильно, что все твердое вещество следует рассматривать как одну большую молекулу. Например, для металлов характерно следующее: внешние электроны атомов образуют конфигурации, простирающиеся по всему куску металла, и электроны свободно переходят от одного атома к другому, поэтому металлы служат хорошими проводниками электрического тока.
При более высоких температурах тепловое движение усиливается и разрушает упорядоченное расположение молекул или атомов в твердом теле. Молекулярные силы все еще держат молекулы плотно упакованными, но уже не могут заставить их располагаться упорядоченным образом. В таких телах сопротивление деформированию или изгибанию отсутствует, однако молекулы все еще остаются друг возле друга - образуется жидкость. Переход от твердого состояния к жидкому зависит от силы межмолекулярного взаимодействия: если оно велико, как в горной породе или в металле, нужна высокая температура, чтобы преодолеть связи, удерживающие молекулы в правильном порядке; если оно мало, как в воде или воздухе, переход в другое агрегатное состояние возможен при меньших температурах.
Когда температура становится выше точки кипения, тепловое движение усиливается настолько, что преодолевает не только упорядочивающее, но и связывающее действие межмолекулярных сил. Тогда молекулы отрываются друг от друга и разлетаются во всех направлениях, сталкиваясь между собой и распределяясь по всему доступному объему, - образуется газ. Температура, при которой образуется газ, также зависит от межмолекулярных сил. В воздухе эти силы столь малы, что не могут удерживать молекулы вместе уже при обычных температурах. В некоторых металлах и горных породах они так велики, что для перехода этих веществ в газообразное состояние нужна температура примерно 2000 °С.
Повышение температуры ослабляет характерные свойства и степень организации вещества. В твердом состоянии вещества имеют типичные формы (кристаллов), обладают специфическим строением и твердостью, их легко распознать. В жидком состоянии собственная форма и структура утеряны - вещество принимает форму сосуда, сохраняются только характерная плотность, цвет и ограничивающая поверхность. Газообразное состояние еще менее специфично. Газообразное вещество не имеет своей характерной плотности и поверхности, остаются только его цвет и запах. Однако во всех трех состояниях вещество построено из одних и тех же молекул или атомов.
Проблема вовлечения химических элементов в производство новых материалов
Последняя проблема учения о составе — вовлечение новых химических элементов в производство материалов. Известно, что 98,6% массы физически доступного слоя Земли составляют всего восемь химических элементов: 47% - кислород, 28% -кремний, 9% - алюминий, 5% - железо, 4% - кальций, 3% -натрий, 3% - калий, 2% - магний. Однако эти ресурсы используются неравномерно. Например, железа содержится в Земле в 2 раза меньше, чем алюминия, но более 95% металлических изделий - конструкций, разнообразных машин и механизмов, транспортных путей — производится из железорудного сырья.
Распространенность кремния (97% массы земной коры составляют силикаты) дает основание утверждать, что силикаты могут стать основным сырьем для производства практически всех строительных материалов и полуфабрикатов, при изготовлении керамики, способной конкурировать с металлами.
Металлы и керамика — материалы, на 90% составляющие материальную основу жизни человека. Достижения химии позволяют заменять металлы керамикой, причем керамика имеет плотность на 40% меньше плотности металлов, что позволяет снизить массу изготовляемых из керамики деталей. Благодаря внедрению в производство керамики таких химических элементов, как цирконий, титан, бор, германий, хром, молибден, вольфрам и др., стали получать керамические изделия с заранее заданными специальными свойствами - огнеупорную, термостойкую, хемостойкую, высокотвердую, а также керамику с набором заданных электрофизических свойств.
В нашей стране в 1960-х гг. получен сверхтвердый материал -гексанит-Р - кристаллическая разновидность нитрида бора с температурой плавления 3200 °С и твердостью, близкой к твердости алмаза, с рекордно высокой вязкостью; у него отсутствует хрупкость, присущая керамике. Такая керамика производится методом прессования порошков с получением необходимых форм и размеров, что делает ненужной дальнейшую обработку. Кроме того, создана керамика, обладающая сверхпроводимостью при температуре выше температуры кипения азота (-195,8 °С). Это открывает перспективы для создания сверхмощных двигателей и электрогенераторов, транспорта на магнитной подушке, для разработки сверхмощных магнитных ускорителей, вывода полезных грузов в Космос и т.п.
Начиная с середины XX в. новые химические элементы (от алюминия до фтора) стали использоваться в синтезе элементе -органических соединений (содержащих химическую связь элемент - углерод). Новые элементоорганические соединения применяют и в качестве химических реагентов для лабораторных исследований, и для синтеза уникальных материалов.
§ 7.3. Химическая структура вещества
Проблемы, решаемые в рамках учения о химической структуре
Развитие знания о химических явлениях позволило установить, что большое влияние на свойства вещества оказывает не только его химический состав, но и структура молекул - их взаимное расположение друг по отношению к другу (упорядоченность). Осознание этого стало началом структурной химии. Ключевым понятием данной концептуальной системы является «структура», точнее, структура молекулы реагента, в том числе макромолекулы или монокристалла. Под структурой обычно понимают устойчивую упорядоченность качественно неизменной системы, казовой является молекула [15, 16].
В изучении структуры вещества оказались важными работы Дж. Дальтона, который в 1803 г. показал, что химический индивид представляет собой совокупность молекул, обладающих строго определенным качественным и количественным составом. В 1830-е гг. Й.Я. Берцелиус выдвинул гипотезу, согласно которой молекула представляет собой не хаотическое нагромождение атомов, а определенную упорядоченность - объединение двух разноименно заряженных атомов или атомных групп (радикалов), способных к самостоятельному существованию. В 1840-х гг. Ш. Жерар сделал вывод, что модель Берцелиуса - достаточно редко отвечает действительности, а в общем случае молекула является единой неделимой системой. В этой системе все атомы химических элементов, входящих в нее, взаимодействуют и взаимно преобразуют друг друга.
В формировании идей структурой химии большую роль сыграла теория валентности Ф.А. Кекуле (1857). Он выдвинул идею о существовании четырех единиц сродства: у углерода четыре единицы сродства, у азота - три, у кислорода - две, у водорода - одна единица. Количество единиц сродства, присущее атому того или иного химического элемента, он назвал валентностью элемента. По представлениям Кекуле, объединение атомов в молекулу происходит путем присоединения свободных единиц сродства. Комбинируя атомы разных химических элементов с их единицами сродства, можно создавать структурные формулы любого химического соединения. Следовательно, возможен синтез любого химического соединения. Присущий формулам Кекуле схематизм наталкивал исследователей на попытки синтеза самых разнообразных веществ путем комбинирования всевозможных органических радикалов и бирадикалов типа СH, СН3, СОН, СН3 и т.д., которые можно получить посредством преобразования соответствующих молекул.
Теория химического строения A.M. Бутлерова добавила к представлениям Кекуле энергетическую оценку связей, показав их энергетическую неэквивалентность. Он доказал, что от количества сродства следует отличать его напряженность - большую или меньшую энергию, с которой она связывает вещества между собой, что является причиной активности одних веществ и пассивности других. Теория Бутлерова также указала на наличие активных центров и активных группировок в структуре молекулы, что способствовало активной деятельности химиков в направлении синтеза органических соединений.
В 1860—1880-е гг. появился термин «органический синтез» и на основе простейших углеводов из каменноугольной смолы и аммиака были синтезированы анилиновые красители - фуксин, анилиновая соль, ализарин, затем индиго, флавоны и ксантоны; взрывчатые вещества - тринитротолуол, тринитрофенол; лекарственные препараты - уротропин, аспирин, фенацетин, антифебрин, салол и др.
Однако сведений только о молекулах вещества, находящегося в дореакционном состоянии, которые давала структурная химия, оказалось недостаточно для того, чтобы управлять процессами превращения веществ. Структурная химия не смогла указать пути получения этилена, ацетилена, бензола и других так называемых диеновых углеводородов с цепочкой С=С-С=С из парафиновых углеводородов, хотя все эти процессы составляют основу нефтехимического производства и легко осуществляются. Производство, основанное на базе органического синтеза, имело очень низкий выход продукции, большие отходы (кроме синтеза азокрасителей и взрывчатых веществ) и требовало использования дорогостоящего сельскохозяйственного сырья — зерна, жиров, молочных продуктов.
Относительно недавно был открыт новый класс металлоорганических соединений, которые за свою двухслойную структуру получили название «сэндвичевые соединения». Молекула этого соединения представляет собой две «пластины» из соединений водорода и углерода, между которыми находится атом какого-либо металла. Они сыграли важную роль в пересмотре представлений о валентности и химической связи. Их можно рассматривать как наглядную демонстрацию наличия у молекул единой системы электронно-ядерного взаимодействия.
Другая группа вопросов в концептуальной системе структурной химии связана с проблемами структурной неорганической химии. По существу это проблемы химии твердого тела. В широком смысле их две:
◊ синтез кристаллов с максимальным приближением к идеальной решетке для получения материалов с высокой механической прочностью, термостойкостью и долговечностью в эксплуатации;
◊ создание методов синтеза кристаллов с запроектированными дефектами решетки, что позволит получить материалы с заданными электрофизическими и оптическими свойствами.
Образование химических структур и химическая связь
Образование различных химических структур имеет свои характерные особенности. Взаимодействуя, атомы соединяются друг с другом, образуя посредством химических связей двух- и многоатомные соединения - молекулы, радикалы, ионы и кристаллы. Образование таких соединений приводит к выигрышу в энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное. Химические связи имеют в основном электромагнитный характер; при их образовании происходит перераспределение электронной плотности связывающихся атомов. Главные отличительные черты химической связи: 1) полная энергия многоатомной системы меньше энергии изолированных атомов или атомных фрагментов, из которых она образована; 2) электронная плотность в области химической связи существенно перераспределена по сравнению с простым наложением электронных плотностей несвязанных атомов или атомных фрагментов, сближенных на расстояние связи.
По характеру распределения электронной плотности связывающихся атомов обычно выделяют следующие основные типы связей:
◊ ковалентная связь, которая осуществляется парой электронов, общих для двух атомов, образующих связь. Атомы в молекуле могут быть соединены неполной ковалентной связью: одинарной (Н2, Н3С−СН3), двойной (Н2С=СН2), тройной (N2, HC≡CH) или полярной (НС1, Н3С—СГ) в зависимости от электроотрицательности;
◊ ионная связь, в основе которой лежит электростатическое взаимодействие между противоположно заряженными ионами - электрически заряженными частицами, которые образуются из атома (молекулы) в результате потери или присоединения одного или нескольких электронов. Положительно заряженные ионы называются катионами, отрицательно заряженные — анионами. Примеры ионной связи - молекулы NaCl и KF;
◊ металлическая связь, которая проявляется при взаимодействии атомов элементов, имеющих избыток свободных валентных орбиталей по отношению к числу валентных электронов; эту связь можно представить так: ионный кристаллический остов погружен в электронный газ - свободные электроны, которые непрерывно перемещаются между положительными ионами и компенсируют электростатическое отталкивание ионов, связывая их в твердое тело;
◊ координационная (донорно-акцепторная) связь характерна для комплексных соединений (гемоглобин, хлорофилл и др.), в молекулах которых выделяют центральный атом (комплексообразователь) и непосредственно связанные с ним молекулы или ионы (лиганды, обычно 4 или 6). Координационная связь обусловлена передачей электронной пары с заполненной орбитали донора на вакантную орбиталь центрального атома (акцептора) с образованием общей связывающей молекулярные орбитали. При этом центральный атом и лиганды образуют внутреннюю сферу. Внешнюю сферу составляют ионы, заряд которых компенсирует заряд внутренней сферы. Например, в [Со(МН3)б]С13 совокупность атомов в квадратных скобках - внутренняя сфера, Со - центральный атом, NH3 - лиганды, ионы С1 - внешняя сфера.
Помимо этого выделяют водородные связи и межмолекулярные взаимодействия. Водородная связь образуется в результате взаимодействия атома водорода, связанного ковалентной связью, с электроотрицательным атомом и неподеленной парой электронов другого атома. Атомы могут принадлежать как одной, так и разным молекулам. Водородная связь приводит к ассоциации одинаковых или различных молекул в комплексы; она во многом определяет свойства воды и льда, молекулярных кристаллов, структуру и свойства белков, нуклеиновых кислот и др. Межмолекулярные взаимодействия электрической природы происходят между молекулами с насыщенными химическими связями. Впервые существование такого взаимодействия принял во внимание Я.Д. Ван-дер-Ваальс (1873) для объяснения свойств реальных газов и жидкостей.
В чистом виде перечисленные типы связей проявляются редко. В большинстве соединений имеет место наложение разных типов связей. При этом любая химическая связь образуется только тогда, когда сближение атомов приводит к уменьшению полной энергии системы.
Среди способов, которыми соединяются атомы друг с другом, стоит подробнее рассмотреть ковалентную связь, т.е. образование общих электронных пар между атомами различных химических элементов, причем здесь главную роль играют валентные электроны, расположенные на внешней оболочке и связанные с ядром атома. Если у атома на внешней оболочке восемь электронов, она называется завершенной. Атомы, имеющие такое строение, обладают большой устойчивостью например, атомы инертных газов Ne, Ar и др.). Внешние оболочки атомов других элементов являются незавершенным и; они завершаются в процессе химических реакций.
Выделяют неполярную и полярную ковалентные связи. H e -полярная ковалентная связь существует в самой простой молекуле - молекуле водорода Н2, состоящей всего из двух атомов водорода. В образовании молекулы участвуют два атома водорода, в каждом из которых на внешней оболочке вращается один электрон. При сближении атомов перекрываются электронные орбитали (рис.7.2, а) и образуется общая пара электронов
H•+•H → H• •H
Каждый из атомов водорода завершает свой внешний уровень (оболочку), образуя при этом устойчивый дуплет электронов. Общая пара электронов, в равной степени принадлежащая каждому из атомов водорода, и есть химическая связь между атомами; поскольку она одна, валентность атома водорода равна единице:
Н—Н
При образовании молекулы азота также происходит возникновение общих электронных пар между атомами элементов. У атома азота на внешнем уровне (оболочке) содержатся пять электронов. Два электрона образуют пару, а три не имеют пары и стремятся ее приобрести. При сближении двух атомов азота образуются три общие электронные пары, следовательно, атом азота трехвалентен:
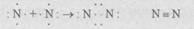
Теперь каждый из атомов азота имеет по восемь электронов на внешнем уровне (оболочке), т.е. оболочка завершена и устойчива.
Примером полярной ковалентной связи служит связь в молекуле воды t^O. Если при образовании молекул водорода и азота атомы в молекулах одинаковы и общая электронная пара в равной степени принадлежит каждому из атомов, то в ситуациях, когда атомы неметаллов различны, общая электронная пара будет оттянута к атому того элемента, который сильнее притягивает и удерживает электроны. Так, молекула воды состоит из двух атомов водорода и одного атома кислорода.
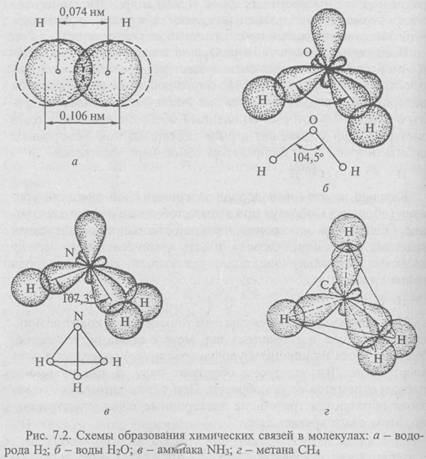
На внешнем уровне (оболочке) атома водорода содержится один электрон, а у атома кислорода - шесть электронов. При сближении атомов кислорода и водорода образуется устойчивая оболочка из восьми электронов у атома кислорода (два не имеющих пары электрона приобретают ее у атома водорода):
На внешнем уровне у атома водорода не остается электронов. До образования молекулы воды электронные облака внешнего слоя (оболочки) атома кислорода находились под углом 90°; в молекуле воды из-за взаимного отталкивания атомов водорода угол связи увеличивается до 104,5° (рис. 7.2, б).
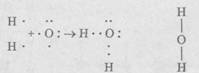
В молекуле аммиака NH3 атом азота имеет пять электронов, из которых два составляют пару; остальные три электрона образуют пары с тремя электронами водорода (рис. 7.2, в):

Атом углерода особенно приспособлен к образованию молекул. Так, в молекуле метана СН4 четыре электрона атома углерода, не имеющих пары, находят недостающие электроны у атома водорода. Атом углерода приобретает устойчивое состояние из восьми электронов. В пространстве электронные облака внешнего слоя (оболочки) атома углерода располагаются под углом 109° и образуют тетраэдр, в вершинах которого размещаются атомы водорода (рис. 7.2, г):
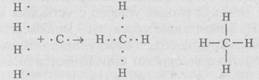
В молекуле диоксида углерода СО2 четыре валентных электрона углерода попарно связаны с двумя атомами кислорода. В результате формируется вытянутая структура из одного атома углерода и двух атомов кислорода по бокам:
С=O=С
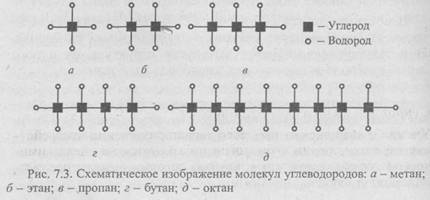
Атом углерода со своими четырьмя валентными электронами может давать нескончаемый ряд молекул (рис. 7.3). Поэтому на Земле широко распространены соединения углерода - метан, этан, пропан, бутан, октан и др. В этих молекулах, начиная с этана, кроме связи углерод-водород появляется связь углерод-углерод:
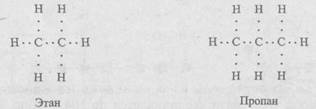
Углеводородные структуры могут иметь любую длину, причем короткие молекулы присущи газам, более длинные - жидкостям и очень длинные — твердым веществам. Углеводороды служат горючим в виде газа, нефти или парафина. Оканчивающиеся карбоксильной группой (рис. 7.4, а) углеводородные цепи называются жирными кислотами; они входят в состав животных жиров. Другие характерные углеводородные структуры - молекулы спиртов (рис. 7.4, б).
Еще одна важная группа молекул с длинными цепями - молекулы углеводов. Их цепи подобны углеводородным, но к каждому звену цепи присоединен кислород. Простейший углевод - глюкоза, один из видов Сахаров (рис. 7.4, в). Такой углевод, как целлюлоза, имеет очень длинную цепь; она присутствует в больших количествах в древесине и других растительных структурах.
Почти вся живая материя построена из аминокислот. На рис. 7.4, г-е показан общий принцип построения таких структур. В скелет этих молекул входит углерод с четырьмя валентными электронами. На одном конце молекулы — карбоксильная группа, на другом - аминогруппа NH2, а между ними - множество других групп; свойства аминокислот определяются именно ими. На рис. 7.4, г, д показаны молекулы двух простейших аминокислот (глицина и аланина), на рис. 7.4, е - в общем виде строение более сложных аминокислот.
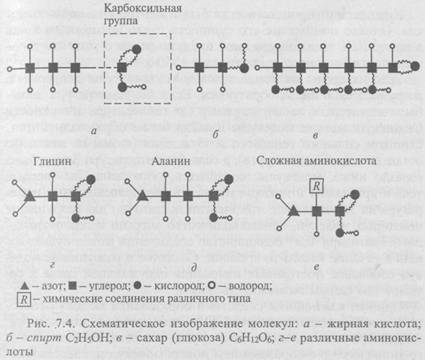
Концевые группы аминокислот обладают весьма характерным свойством - они легко соединяются. Аминогруппа и карбоксильная группа связываются друг с другом, и аминокислоты образуют длинные цепи (одна аминокислота как бы цепляется за другую). Такие цепи называются белками и играют важную роль в жизни живых организмов.
§ 7.4. Химические процессы
Сущность химического процесса
Учение о химическом процессе характеризуется взаимодействием физики, химии и биологии и базируется на идеях химической термодинамики и кинетики, которые обычно рассматриваются в физической химии.
Химический процесс всегда был в центре внимания химиков. Однако понимание его сущности стало возможным лишь в конце XIX в., а современное представление о том, что такое химический процесс, сложилось в 1950-х гг.
Условия среды на Земле таковы, что молекулы непрерывно разрушаются и снова образуются. Если бы температура Земли была значительно выше, например как температура поверхности Солнца, то многие молекулы никогда бы не образовались из-за слишком сильного теплового возбуждения (атомы не могли бы оставаться друг возле друга), а если бы температура Земли была гораздо ниже, молекулы, соединяясь, образовали бы твердые тела и кристаллы и никакие изменения не происходили. Температура на Земле такова, что энергии достаточно для разрушения некоторых молекул, однако количество энергии не слишком велико, благодаря чему большинство соединений может существовать в течение какого-то времени. Создание и разрушение молекул сообщают постоянные изменения окружающей среде и создают тем самым возможность жизни.
Одно из важнейших следствий образования молекул состоит в высвобождении энергии [2]. Этот процесс особенно нагляден при сжигании угля или других веществ. Горение любого типа связано с образованием новых молекул и, следовательно, с выделением тепловой энергии. Рассмотрим подробнее, как и почему высвобождается энергия при соединении атомов в молекулы. Понятно, что для разрыва химической связи требуется некоторое количество энергии и такое же ее количество высвобождается при образовании связи. Таким образом, нужно затратить энергию, чтобы разделить молекулу на атомы, и энергия выделяется, когда атомы образуют молекулу. Эта энергия проявляется в различных формах, например в виде колебаний. Когда атомы соединяются, образующаяся молекула начинает колебаться в результате сильного столкновения атомов. Вообще, когда атомы образуют молекулу, энергия высвобождается и обычно проявляется в форме движения, что эквивалентно теплоте. В некоторых особых случаях энергия связи не превращается в теплоту: химические реакции присоединения происходят таким образом, что энергия, выигранная при образовании молекул, передается молекулам другого рода, т.е. энергия образования молекулы запасается в другой молекуле, а не растрачивается в виде теплоты. Этот случай важен для поддержания жизни.
Обратимся к такому хорошо известному химическому процессу, как процесс горения угля. Углерод угля и кислород воздуха образуют углекислый газ - диоксид углерода. Кусок угля - это совокупность атомов углерода, расположенных в правильном порядке, т.е. кристалл углерода. Кислород воздуха состоит из молекул кислорода. Поэтому химическая реакция горения угля имеет вид
С + О2=СО2.
Эта реакция происходит в два этапа: сначала разрывается связь в молекуле О2, а затем два атома кислорода присоединяются к углероду. Первый этап требует затрат энергии. При обычных температурах тепловой энергии недостаточно для расщепления молекулы кислорода на два атома, как в тех случаях, когда уголь соприкасается с воздухом без горения. Но если подвести теплоту от зажженной спички или горящей щепки, то реакция начнется. На втором ее этапе при образовании СО2 выделяется больше энергии, чем требуется для расщепления О2 (рис. 7.5, а). Поэтому энергия, необходимая для дальнейшего расщепления О2, поставляется самим процессом горения. Таким образом, при горении угля большая часть энергии выделяется в виде теплоты, а часть энергии, высвобождаемой на втором этапе, идет на инициирование дальнейших реакций. Полезная теплота равна избытку энергии, выделяющейся на втором этапе, над энергией, потребной для первого этапа.
Начавшись, образование диоксида углерода продолжается до тех пор, пока не израсходуется весь углерод. При этом выделяется большое количество теплоты. Нагревание столь сильно, что атомы и молекулы начинают испускать свет. Пламя, которое мы видим при горении угля, состоит из молекул СO2 и атомов углерода, выброшенных в результате сильного нагрева и испускающих излучение. Таким образом, пламя не вид вещества (флогистон), как некогда полагали. Это накаленная материя, полученная в химической реакции, в которой выделяется очень много энергии.
Горение угля - простейшая форма выделения химической энергии. Аналогичный процесс происходит при горении метана и других углеводородов. Здесь требуется начальная теплота, чтобы расщепить и молекулы О2, и молекулы углеводорода. После этого углерод соединяется с кислородом, образуя диоксид углерода, а водород соединяется с кислородом, образуя воду. Химическая реакция горения метана СН4 показана на рис. 7.5 б.
Так как в молекулах СН4 и О2 связи существенно слабее, чем в молекулах СО2 и Н2О, чистый выигрыш энергии в данной реакции очень велик. Поэтому метан и другие углеводороды дают сильное пламя и много теплоты. Однако в отличие от горения угля в пламени углеводородов вместе с раскаленным СО2 содержится водяной пар. Если подержать холодное стекло в пламени свечи или горящего дерева, то на стекле образуется конденсированный водяной пар, который не получается в пламени чистого угля.
Таким же образом любая молекула, состоящая из углерода, водорода и кислорода, может гореть, т.е. превращаться в углекислый газ и водяной пар, соединяясь с кислородом воздуха. Но для горения молекул спирта или сахара нужно меньшее количество кислорода, поскольку они сами содержат О2.
Химические реакции, производящие энергию, всегда начинаются с превращения молекул со слабыми связями в молекулы с прочными связями; при этом высвобождается разница в энергиях сильной и слабой связи. Молекулы СО2 и воды имеют прочные связи; то же можно сказать о большинстве молекул, в которых атомы связаны с кислородом. Молекулы, содержащие углерод и водород, связаны слабо, они легко разрушаются и рекомбинируют, могут образовывать длинные цепи и способны объединяться в сложные структуры. Если их слабые связи превращаются в сильные связи с кислородом в результате какого-либо сложного процесса, то выделяется энергия. Благодаря этим свойствам они играют важную роль в живой материи.

Принципы управления химическим процессом
Основная проблема в учении о химических процессах связана с тем, что многие химические реакции были и остаются трудноуправляемыми. Одни из них пока не удается осуществить, хотя в принципе они выполнимы. Другие сложно остановить, например реакцию горения и взрывы. Трудности управления третьими обусловлены тем, что в их процессе самопроизвольно создается множество непредвиденных ответвлений с образованием побочных продуктов [15, 16].
Суть проблемы заключается в следующем. Каждая химическая реакция обратима и представляет собой перераспределение химических связей. Обратимость служит основанием равновесия между прямой и обратной реакциями. Однако на практике равновесие смещается в ту или иную сторону в зависимости от природы реагентов и условий процесса. Реакции, в которых равновесие смещено «вправо» - в сторону образования целевых продуктов, обычно не требуют особых средств управления. Таковы реакции кислотно-основного взаимодействия, или нейтрализации, а также реакции, сопровождающиеся удалением готовых продуктов в виде газов или осадков.
Однако немало реакций происходит со смещением равновесия «влево». Для их осуществления требуется особое термодинамическое управление. Такова, в частности, реакция синтеза аммиака:
N2 + 3Н2 ↔ NH3.
Эта реакция очень проста с точки зрения состава и структуры исходных веществ. Но на протяжении XIX в. попытки ее осуществления приводили к неудачам. В настоящее время решение проблемы управления химическими процессами продвинулось далеко вперед. Среди основных методов управления ими выделяют термодинамические и кинетические (в первую очередь каталитические).
Основы теории термодинамических методов управления химическими процессами были заложены в конце XIX в. в рамках химической термодинамики, которая изучает химические превращения на основе представления о термодинамическом равновесии в макроскопических системах. Химическая термодинамика включает учения о химическом равновесии, растворах, фазовых переходах и процессах на границе раздела фаз. В их основу положены идеи нидерландского ученого Я.Х. Вант-Гоффа, установившего зависимость направления химической реакции от изменения температуры и теплового эффекта реакции, а также принцип подвижного равновесия французского исследователя А.Л. Ле Шателье, согласно которому каждая реакция обратима, но равновесие смещается в зависимости от природы реагентов и условий процесса. Таким образом, основными рычагами управления реакцией служат температура, давление и концентрации реагирующих веществ.
В настоящее время термодинамические соотношения широко применяют для определения максимально возможного (при данных температуре, давлении и т.п.) выхода продуктов химических реакций и прочих параметров технологических процессов в химической, металлургической и других отраслях промышленности. Использование понятий и методов термодинамики неравновесных процессов позволяет оценивать потоки теплоты и вещества для открытых систем с учетом скоростей химических превращений, но влиять только на направленность.
Кинетические (в первую очередь каталитические) методы дают возможность влиять и на скорость химических процессов. Эти методы активно развиваются в рамках химической кинетики - учения о скоростях и механизмах химических реакций, надежной основы создания новых и совершенствования существующих процессов химической технологии: горения, гетерогенного катализа, электрохимических процессов и др. Методы химической кинетики используются в биологии и других областях естествознания. С их помощью удается добиться изменения хода процессов при изменении структурно-кинетических факторов: строения исходных реагентов, их концентрации, наличия в реакторе катализаторов (веществ, ускоряющих химические реакции), ингибиторов (веществ, замедляющих реакции) и других добавок, способов смешения реагентов, материала и конструкции реакторов и т.д.
К наиболее важным кинетическим методам относится ускорение химической реакции в присутствии катализаторов — катализ (от греч. katalysis — разрушение). Катализаторы (синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др.) взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав продуктов. Катализ был открыт в 1812 г. российским ученым К.Г.С. Кирхгофом, который получил сахар с помощью катализатора (серной кислоты) из крахмала. Различают гомогенный катализ, когда исходные реагенты и катализатор находятся в одной фазе (газовой или жидкой), и гетерогенный, когда газообразные или жидкие реагенты взаимодействуют на поверхности твердого катализатора. Катализ обусловливает высокие скорости реакций при небольших температурах. Каталитические реакции являются основой многих химико-технологических процессов (например, производства серной кислоты, некоторых полимеров, аммиака). Большинство процессов, происходящих в живых организмах, также являются каталитическими (или ферментативными, так как биологические катализаторы называются ферментами).
На современном уровне знания суть катализа может быть охарактеризована следующим образом. Во-первых, катализ представляет собой способ проведения химических реакций, особенность которого состоит в активизации молекул и ослаблении химических связей реагента при их контакте с катализатором. Во-вторых, в общем случае любую каталитическую реакцию можно представить проходящей через промежуточный комплекс, в котором происходит перераспределение ослабленных (неполновалентных) химических связей. В-третьих, в большинстве случаев в качестве катализаторов выступают соединения, молекулы которых содержат широкий набор энергетических неоднородных связей или даже свободные атомы на поверхности. В-четвертых, следствием взаимодействия молекул реагента с катализатором является не только ослабление исходных связей, а еще четыре эффекта: 1) химическая ориентация в заданном направлении, при котором катализатор выбирает из нескольких возможных направлений какое-либо одно; 2) матричная ориентация реакций, проявляющаяся в том, что изменение структуры молекул реагента определяется особенностями геометрического строения катализатора или особенностями структуры каталитического комплекса; 3) увеличение количества встреч реагирующих молекул при переводе реакции из объема на поверхность катализатора; 4) захват твердым телом катализатора некоторой части энергии реакции, т.е. превращение катализатора в «энергетическую ловушку» для энергетической подпитки новых актов реакции.
§ 7.5. Химическая эволюция
Этапы химической эволюции
Химическая эволюция — процесс необратимых изменений, приводящий к появлению новых химических соединений - продуктов, более сложных и высокоорганизованных по сравнению с исходными веществами. Эти процессы стали активно и целенаправленно исследовать в 1970-е гг. в связи с изучением проблемы постоянно усложняющихся химических процессов до уровня, способствовавшего возникновению живого вещества на Земле. Интерес к этим процессам восходит к давним попыткам понять, как из неорганической материи возникает органическая, а далее и жизнь. Первым осознал высокую упорядоченность и эффективность химических процессов в живых организмах основатель органической химии Й.Я. Берцелиус (конец XVIII - начало XIX в.). Он установил, что основой лаборатории живого организма является биокатализ. Большое значение каталитическому опыту живой природы придавалось и в XX в. Так, академик H.H. Семенов рассматривал химические процессы, протекающие в тканях растений и животных, как своеобразное «химическое производство» живой природы.
Кратко рассмотрим этапы химической эволюции [5, 23]. Вероятно, следует признать, что она началась с появлением простейшего носителя - атома. Согласно концепции Большого взрыва, существующие сейчас химические элементы возникли в процессе эволюции Вселенной от сверхплотного и сверхгорячего состояния до современного мира звезд и галактик. Предполагается, что первыми образовались простейшие атомы (вернее, их ядра) водорода. Приблизительно через 1 с после Большого взрыва плотность материи уменьшилась до 1 т/см3, температура - до 100 млрд К, а диаметр вырос до 1500 млрд км. Вещество находилось в состоянии полностью ионизированной плазмы, состоящей из нуклонов (протонов и нейтронов) и электронов. Еще через 10 с, когда температура понизилась до 10 млрд К, появились условия для протекания ядерной реакции образования дейтронов — ядер дейтерия (тяжелого водорода).
Однако при этой температуре равновесие данной реакции сильно сдвинуто влево (оно сдвигается вправо только при температуре 1млрд К - примерно через 100 с после Большого взрыва), и дейтроны не могли накапливаться, так как они при этих условиях превращаются в ядра гелия (эта схема вполне удовлетворительно объясняет количество гелия в нашей Вселенной). На дозвездной стадии развития материи ядра других химических элементов не образуются, поскольку плотность и температура расширяющейся Вселенной быстро падают. При этом процесс образования 4Не (цифра слева вверху - относительная атомная масса, т.е. масса атома, выраженная в атомных единицах массы, которая составляет 1/12 массы изотопа углерода с массовым числом 12 — 1,6605655(86)10-27 кг), начавшись приблизительно через 2 мин после Большого взрыва, прекращается уже к концу 4-й минуты. При остывании Вселенной до температуры 3500 К (приблизительно через 1 млн лет) происходит рекомбинация ядер гелия и оставшихся ядер водорода с электронами: образуются атомы гелия и водорода — исходный материал для межзвездного газа и звездных систем.
Дальнейший синтез химических элементов продолжается, в недрах звезд при повышении температуры. В процессе конденсации в протозвезду межзвездного газа, состоящего из водорода и гелия, в результате гравитационного сжатия температура повышается и снова становится возможной реакция образования гелия из водорода. Этот этап характеризуется температурами, не превышающими 20 106 К.
После ядер гелия 4Не наиболее устойчивыми являются ядра 12С и О. Термоядерная эпоха образования таких ядер (Т ≈ 100 млн К) наступает после того, как на первом этапе истощается, «выгорает» водород. В эту эпоху в плотных выгоревших ядрах звезд-гигантов возможно непосредственное образование углерода и кислорода (не атомов, а ядер). Дальнейшее слияние ядер гелия приводит к образованию 20Ne, 24Mg и т.п. Более поздняя ядерная эпоха, когда обеспечивается температура до 1 млрд К, характеризуется «горением» углерода. При этом образуются ядра вплоть до 27А1 и 28Si. Выше 30 млрд К в реакцию вступают более тяжелые ядра, начиная с кремния 32Si В условиях складывающегося при этом термодинамического равновесия синтезируются элементы вплоть до железа и атомы близких ему элементов, ядра которых являются самыми стабильными ядрами. При этом достигается минимум энергии всей системы, и более тяжелые ядра не синтезируются. Получение элементов с большими атомными номерами осуществляется по другому механизму — последовательный захват ядрами нейтронов и последующий β-распад. В подобных процессах в качестве самого тяжелого может получиться нуклид 181Bi. Ядра, более тяжелые, чем 181Bi, синтезируются во время взрывов новых и сверхновых звезд в условиях огромной плотности нейтронных потоков, когда возможен захват ядрами нейтронов не по одному, а группами.
Можно с большой долей вероятности предположить, что в Солнечной системе сменилось несколько этапов ядерного синтеза. Сравнение химического состава Солнца и химического состава звездного вещества позволяет заключить, что все описанные выше процессы синтеза ядер имели место в Солнечной системе, причем первоначальная масса образовавшейся в нашем участке Галактики звезды превышала критическую (равную 1,44 массы Солнца), и она оказалась неустойчивой. Под действием гравитационного притяжения протозвезда сжималась, ее температура повышалась, обеспечивая первые этапы ядерного синтеза. Выделяющаяся при этом энергия оказалась слишком велика, вследствие чего через некоторое время происходил взрыв и образовывались ядра самых тяжелых элементов. Масса звезды уменьшалась за счет выброса вещества. Этот процесс повторялся неоднократно до тех пор, пока масса центральной массивной звезды не стала ниже критического предела. Такой механизм обеспечивает интервал времени, достаточный для химической, геолого-географической и биологической эволюции.
В настоящее время многие исследователи полагают, что планеты Солнечной системы образовались из солнечной материи, выброшенной из Солнца, когда оно становилось сверхновой звездой. Охлаждение образовавшейся вокруг Солнца дискообразной газовой туманности дало возможность для соединения атомов в молекулы, т.е. началась собственно химическая эволюция.
Молекулы не могли образоваться при звездных температурах, когда большинство атомов существует в виде многозарядных ионов (например, в солнечной короне при 1 млн К атомы железа являются ионами Fe134). Двухатомные молекулы обнаружены в спектрах лишь наиболее холодных звезд с температурой поверхности 2000-3000 К (оксиды AI, Mg, Ti, Zr, C, Si и некоторые другие двухатомные молекулы с наиболее прочной химической связью). При этом в межзвездном пространстве присутствует большое количество молекул, в том числе достаточно сложных (табл. 7.1). Предполагается, что состав указанных молекул соответствует составу первых молекул, образовавшихся в результате охлаждения звездного вещества. Найдены и другие молекулы, но в значительно меньших количествах.
Таблица 7.1. Молекулы, обнаруженные в межзвездном пространстве [5, 23]
Наименование молекулы |
Химическая формула |
Наименование молекулы |
Химическая формула |
Метилидин-радикал |
СН |
Муравьиная кислота |
НСООН |
Циан-радикал |
CN |
Сероводород |
H3S |
Гидроксид-ион |
ОН- |
Оксид серы (II) |
SO |
Аммиак |
NH3 |
Этанол |
С2Н5ОН |
Вода |
Н2О |
Диметиловый эфир |
(СН3)2O |
Метилацетилен |
СН3ССН |
Оксид серы (IV) |
SO2 |
Изоциановая кислота |
HNCO |
Сульфид кремния (II) |
SiS |
Тиоформальдегид |
H2CS |
Цианоацетилен |
HCCCN |
Оксид кремния (II) |
SiO |
Формамид |
HC(O)NH2 |
Уксусный альдегид |
СН3СНО |
Сульфид углерода (II) |
CS |
Формальдегид |
НСНО |
Ацетонитрил |
CH3CN |
Водород |
Н2 |
Этинил-радикал |
HC≡C |
Оксид углерода (II) |
СО |
Метиламин |
CH3NH2 |
Циановодород |
HCN |
Акрилонитрил |
H2C=CHCN |
Метанол |
СН3ОН |
Метилформиат |
НСООСН3 |
Когда температура протопланетной туманности понизилась до 1000-1800 К, начали конденсироваться, т.е. становиться жидкими и твердыми, самые тугоплавкие вещества, в частности образовались капельки железа, а впоследствии и силикатов (солей кремниевых кислот).
При температурах 400-1000 К конденсировались другие металлы и их соединения с серой и кислородом. Застывшие капли силикатного материала в виде хондр (маленьких сферических тел) образовали, по-видимому, при последующем сгущении множество астероидов - первичных тел хондритовых метеоритов. Можно предположить, что в результате дифференциации первичного газа под действием солнечного ветра (истечения плазмы солнечной короны в межпланетное пространство) и градиента температур атомы наиболее легких элементов были отброшены на периферию Солнечной системы и расположенные ближе к Солнцу планеты земного типа возникли путем сгущения наиболее высокотемпературной фракции с повышенным содержанием железа.
Содержание летучих компонентов, которые, вероятно, попали в планетное вещество главным образом в результате адсорбции на пылевых частицах или химических реакций с ними, оказалось очень малым. Поэтому масса гидросферы Земли составляет лишь 0,024%, а атмосферы - 0,00009% общей массы Земли.
С формированием Земли как планеты на химическую эволюцию стала оказывать действие эволюция Земли. Это влияние выражалось (и выражается в настоящее время) в изменении концентрационного распределения химических элементов в теле Земли и по ее оболочкам (в атмосфере, гидросфере, коре, мантии, ядре), а также в создании условий (температура, давление) для образования новых веществ.
Конечно, при этом имело место и обратное воздействие. Образование новых веществ и появление возможностей для новых химических процессов вызывали формирование новых геологических образований, например осадочных пород. Таким образом, геологическая и химическая эволюции протекают в значительной степени совместно, взаимно влияя друг на друга. Химическая эволюция привела к появлению жизни. Это произошло благодаря развитию не веществ, а химических систем и процессов, в них происходящих.
Проблема самоорганизации химических систем
Выделяют субстратный и функциональный подходы к решению проблем самоорганизации предбиологических химических систем в биологические [15,16]. Результатом субстратного подхода к проблеме биогенеза является накопленная информация об отборе химических элементов и структур.
Считается, что многие из 109 открытых на сегодня химических элементов, попадая в живые организмы, участвуют в их жизнедеятельности. Основу живых систем составляют шесть элементов - органогенов: углерод, водород, кислород, азот, фосфор и сера. Общая весовая доля этих элементов в организмах составляет около 97,4%. За ними следуют еще 12 элементов, которые принимают участие в построении многих физиологически важных компонентов биосистем: натрий, калий, кальций, магний, алюминий, железо, кремний, хлор, медь, цинк, кобальт, никель. Их весовая доля в организмах примерно 1,6%. Еще около 20 элементов участвуют в построении и функционировании узкоспецифических биосистем, например водорослей, состав которых определяется в известной мере питательной средой. Участие всех остальных элементов в построении биосистем практически не зафиксировано. При этом в настоящее время насчитывается более 5 млн химических соединений, из которых 96% - органические, состоящие из перечисленных 6-18 элементов. Остальные 90 химических элементов в условиях Земли входят всего в 300 тыс. неорганических соединений.
Наиболее распространенные на Земле органогены - кислород и водород. Распространенность углерода, азота, фосфора и серы в поверхностных слоях Земли примерно одинакова и в общем невелика — около 0,24% по весу. В то же время можно говорить о господстве во Вселенной двух элементов - водорода и гелия, а все остальные элементы следует рассматривать как примесь к ним. Таким образом, геохимические условия не играют существенной роли в отборе химических элементов при формировании органических и биологических систем. Определяющими факторами выступают требования соответствия между строительным материалом и высокоорганизованными структурами, из которых они сооружаются.
С химической точки зрения эти требования сводятся к отбору элементов, способных образовывать прочные и энергоемкие связи, причем связи лабильные. Указанным условиям отвечает углерод, который способен вмещать и удерживать внутри себя самые редкие химические противоположности. Азот, фосфор, сера как органогены, а также железо и магний, составляющие активные центры ферментов, тоже отличаются лабильностью. Кислород и водород не столь лабильны, но они являются носителями окислительных и восстановительных процессов.
Подобно тому как из всех химических элементов только шесть органогенов и 10-16 других элементов отобраны природой для основы биосистем, так и в ходе эволюции шел отбор химических соединений. Из миллионов органических соединений в построении живого участвуют только несколько сот. Более того, из 100 известных аминокислот в состав белков входят 20 и только по четыре нуклеотида ДНК (дезоксирибонуклеиновая кислота - высокомолекулярное соединение, содержащееся в ядрах клеток живых организмов; вместе с белками образует вещество хромосом, ДНК — носитель генетической информации) и РНК (рибонуклеиновая кислота — высокомолекулярное соединение, участвующее в реализации генетической информации в клетках всех живых организмов) составляют основу всех сложных полимерных нуклеиновых кислот, ответственных за наследственность и регуляцию белкового синтеза в любых живых организмах.
Из такого узкого круга органических веществ построено все разнообразие мира животных и растений. Полагают, что, когда период химической подготовки сменился периодом биологической эволюции, химическая эволюция в каком-то смысле застыла. Доказательством этого служит тот факт, что аминокислотный состав гемоглобина самых низших позвоночных животных и человека практически один и тот же. Более или менее одинаковыми остаются у разных видов растений состав ферментативных средств, состав веществ, накапливаемых впрок, и т.п.
Одна из важнейших задач науки связана с определением пути химической подготовки, в результате которой из минимума химических элементов и химических соединений образовался сложнейший высокоорганизованный комплекс — биосистема. Это важно выяснить для того, чтобы научиться у природы (а затем, может быть, и пойти дальше ее) приспособлять к своим нуждам «менее организованные материалы», например синтезировать сахар из СO2, СО, Н2 и Н2О и т.д. Последние научные открытия показывают, что в ходе химической эволюции отбирались те структуры, которые способствовали повышению активности и селективности действия каталитических групп. Первая и наиболее простая структура - различные фазовые границы. Они служили основой физической и химической адсорбции, которая вносила элементарное упорядочение во взаимное расположение частиц, увеличивала их концентрацию и выступала фактором проявления каталитического эффекта. Вторым структурным фрагментом считают группировки, обеспечивающие процессы переноса электронов и протонов, — полупроводниковые цепи и структуры, ответственные за перенос водорода. Третья структура, необходимая для эволюционирующих систем, - группировки, выполняющие задачу энергетического обеспечения; к ним относятся оксиоксогруппы, фосфорсодержащие и др.
Следующим фрагментом эволюционирующих систем является развитая полимерная структура типа РНК и ДНК. Она выполняет ряд функций, свойственных перечисленным выше структурам, а главное - роль каталитической матрицы, на которой осуществляется воспроизведение себе подобных структур. В связи с этим привлекает внимание ряд выводов, полученных различными путями в самых разных областях науки (геологии, геохимии, космохимии, термодинамике, химической кинетике). Во-первых, считается, что на ранних стадиях химической эволюции мира катализ отсутствовал. Высокие температуры (намного более 5000 К), электрические разряды и радиация препятствуют образованию конденсированного состояния и перекрывают те порции энергии, которые необходимы для преодоления энергетических барьеров. Во-втоpых, проявления катализа возможны при смягчении условий образования первичных твердых тел. В-третьих, роль катализатора возрастала по мере того, как условия (главным образом температура) приближались к существующим сейчас на Земле. Но общее значение катализа еще не могло быть высоким вплоть до образования более или менее сложных органических молекул. В-четвертых, появление таких относительно несложных систем, как С3ОН, СН2=СН2, НС=СН, Н2СО, НСООН, HC≡N, а тем более оксикислот, аминокислот и первичных Сахаров, было некаталитической подготовкой старта для большого катализа. В-пятых, роль катализа в развитии химических систем начала сильно возрастать после достижения стартового состояния - известного количественного минимума органических и неорганических соединений. Отбор активных соединений происходил из тех продуктов, которые получались относительно большим числом химических путей и обладали широким каталитическим спектром.
Отличительной чертой функционального подхода к проблеме предбиологической эволюции является концентрация усилий на исследовании самоорганизации материальных систем, на выявлении законов, которым подчиняются такие процессы. Этот подход получил большое распространение у физиков и математиков, рассматривающих эволюционные процессы с позиции кибернетики. Крайней точкой зрения здесь является утверждение о полном безразличии к материалу эволюционных систем, поэтому живые системы, вплоть до интеллекта, могут быть смоделированы, например, из металлических систем.
В 1960-е гг. А.П. Руденко выдвинул общую теорию химической эволюции и биогенеза. Он осуществил синтез рациональных сторон субстратного и функционального подходов. Его теория в комплексе решает вопросы о движущих силах и механизме эволюционного процесса, т.е. о законах химической эволюции, отборе элементов и структур и их причинной обусловленности, химической организации и иерархии химических систем как следствии эволюции. Пока только эта теория может служить основанием эволюционной химии как новой концептуальной системы.
Сущность данной теории состоит в утверждении, что химическая эволюция представляет собой саморазвитие каталитических систем и, следовательно, эволюционирующим веществом являются катализаторы. В ходе реакции происходит естественный отбор наиболее активных каталитических центров. Те же центры, изменение которых связано с уменьшением активности, постепенно исключаются из кинетического процесса. При многократных последовательных необратимых изменениях катализатора переход его на все более высокие уровни сопровождается эволюцией базисной реакции как за счет изменений состава и структуры катализаторов, функционировавших в начале реакции, так и вследствие дробления химического процесса на элементарные стадии и появления на них новых катализаторов, которые появляются не путем захвата их из внешней среды, а благодаря саморазвитию.
Руденко сформулировал основной закон химической эволюции, согласно которому с наибольшей скоростью и вероятностью реализуются те пути эволюционных изменений катализатора, на которых происходит максимальное увеличение его абсолютной активности.
Считается, что саморазвитие, самоорганизация и самоусложнение каталитических систем обусловлены постоянным потоком трансформируемой энергии. А так как главным источником энергии служит базисная реакция, то максимальные эволюционные преимущества получают каталитические системы, развивающиеся на основе реакций с самым большим сродством (экзотермические реакции). Таким образом, базисная реакция является не только источником энергии, необходимой для полезной работы в системе, которая направлена против равновесия, но и инструментом отбора наиболее совершенных эволюционных изменений в катализаторе.
Теория саморазвития открытых каталитических систем имеет ряд важных следствий. Во-первых, можно классифицировать этапы химической эволюции, а на этой основе классифицировать катализаторы по уровню их организации следующим образом: кристаллы, близкие к идеальным, - реальные кристаллы после раскристаллизации — реальные кристаллы с включением примесей из сферы реакций - твердые кристаллы с хемосорбированными комплексами - гомогенные каталитические системы - микрогетерогенные и коллоидные системы.
Во-вторых, появляется принципиально новый метод изучения катализа как динамического явления, связанного с изменением катализаторов в ходе реакций.
В-третьих, дается конкретная характеристика пределов химической эволюции и перехода от хемогенеза к биогенезу в результате преодоления так называемого второго кинетического предела саморазвития каталитических систем.
В настоящее время набирает потенциал новое направление, расширяющее представление об эволюции химических систем, — нестационарная кинетика, которая занимается теорией управления нестационарными процессами. Развитие химических знаний позволяет надеяться на разрешение многих проблем, стоящих перед человечеством: значительное ускорение химических превращений в «мягких» условиях; осуществление новых, энергетически затрудненных процессов путем сопряжения эндо- и экзотермических реакций; возможность экономии углеводородного сырья и переход от нефти к углю -более распространенному сырьевому источнику. Химия имеет реальные предпосылки для моделирования и интенсификации фотосинтеза; фотолиза воды с получением водорода как самого высокоэффективного и экологически чистого топлива; промышленного синтеза на основе углекислого газа широкого спектра органических продуктов, в первую очередь метанола, этанола, формальдегида и муравьиной кислоты; промышленного синтеза многочисленных фторматериалов. Сегодня созрели условия для создания малоотходных и энергосберегающих промышленных производств.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. В чем заключается сущность химических явлений? От чего зависят свойства веществ?
2. Что такое концептуальные системы химии? Какие концептуальные системы химии вы знаете?
3. Какие основные проблемы состава вещества вы знаете? Кратко охарактеризуйте их.
4. Дайте определение химического элемента. Сколько их известно и почему этих элементов ограниченное количество?
5. Что такое химическое соединение? Как в настоящее время определяют понятие «молекула»?
6. Что такое структура молекулы реагента? Какие проблемы решаются в рамках изучения структуры вещества?
7. Как происходит образование химических структур и что такое химическая связь? Какие химические связи вы знаете?
8. Что такое химический процесс? Почему в процессе химических реакций происходят поглощение и выделение энергии? Приведите примеры.
9. Каковы основные принципы управления химическими процессами?
- Что такое каталитические системы?
- Назовите основные этапы химической эволюции.
- Какие проблемы изучения химической эволюции вы знаете?
- В чем сущность идеи саморазвивающихся каталитических систем?
ЛИТЕРАТУРА
- Ахметьев Н.С. Неорганическая химия. М., 1975.
- Вайскопф В. Наука и удивительное. Как человек понимает природу. М., 1965.
- Глинка Н.Л. Общая химия. М., 1982.
- Грядовой Д.И. Концепции современного естествознания: Структурный курс основ естествознания. М., 2000.
- Гузей Л.С., Кузнецов В.Н., Гузей A.C. Общая химия. М., 1999.
- Добротин Р.Б. Состав-структура-процесс. Л., 1984.
- Дубнищева Т.Я. Концепции современного естествознания. Новосибирск, 1997.
- Карапетьянц М.Х. Введение в теорию химических процессов. М., 1978.
- Карапетьянц М.Х., Дракин Е.И. Строение вещества. М., 1978.
- Кемпбел Дж. Современная общая химия. Т. 1, 2. М., 1975.
- Концепции современного естествознания /Под ред. В.Н. Лавриненко, В.П. Ратникова. М., 1997.
- Коулсон Ч. Валентность. М., 1965.
- Краснов К.С. Молекулы и химическая связь. М., 1977.
- Крестов Г.А., Березин Б.Д. Основные понятия современной химии. Л., 1986.
- Кузнецов В.И. Общая химия. Тенденция развития. М., 1989.
- Кузнецов В.И., Идлис Г.М., Гутина В.Н. Естествознание. М., 1996.
- Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. М., 1997.
- Курс химии. Ч. 1: Общетеоретическая / Под ред. Г.А. Дмитриева, Г.П. Лучинского, В.И. Семишина. М., 1971.
- Минкин В.И., Симкин Б.Я., Миняев P.M. Теория строения молекул. Электронные оболочки. М., 1979.
- Некрасов Б.В. Основы общей химии. М., 1976.
- Несмеянов А.А., Несмеянов H.A. Органическая химия. Т. 1, 2. М., 1969-1970.
- Николаев Л.А. Современная химия. М., 1970.
- Общая химия /Под ред. Е.М. Соколовской, Л.С. Гузея. М., 1989.
- Полинг Л., Полине П. Химия. М., 1978.
- Реми Г. Курс неорганической химии. Т. 1, 2. М., 1972, 1974.
- Слейбо У., Персоне Т. Общая химия. М., 1979.
- Соловьев Ю.И. История химии. М., 1976.
- Татевский В.М. Строение молекул. М., 1977.
- Третьяков Ю.Д., Метлин Ю.Г. Основы общей химии. М., 1980.
- Фигурновский H.A. История химии. М., 1979.
- Химический энциклопедический словарь. М., 1983.
- Химия: Справочные материалы /Под ред. Ю.А. Третьякова. М., 1994.
- Хомченко Г.П. Химия для поступающих в вузы. М., 1996.
- Щукарев С.А. Неорганическая химия. Т. 1, 2. М., 1970, 1974.
- Эрдеи-Груз Т. Основы строения материи. М., 1976.
.
Ваш комментарий о книге
Обратно в раздел Наука
|
|
